6
月
15
日,美国癌症基因组图谱
(TCGA)
研究网络在著名的
Cell
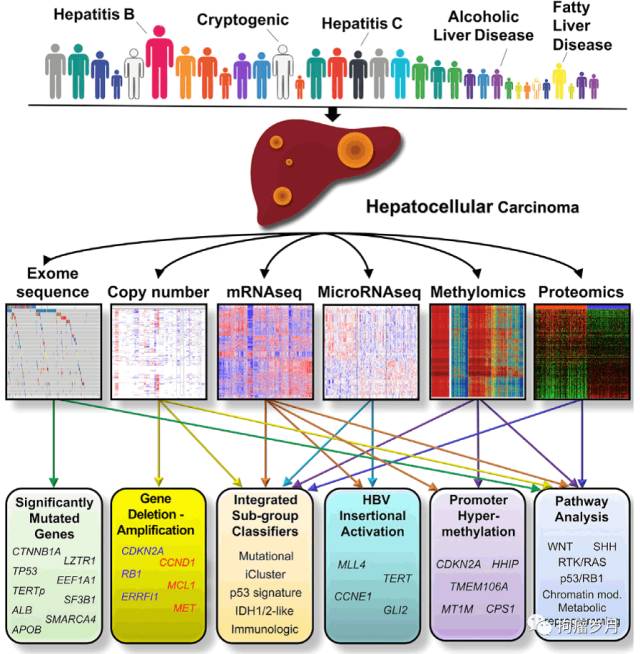
杂志发表了其肝癌项目的数据。为这一人类迄今最大规模的癌症基因组项目又增加了一份重磅成果。
研究者通过全外显子测序和
DNA
拷贝数分析的方法分析了
363
例肝细胞癌
(HCC)
病例;并通过
DNA
甲基化、
RNA
、
miRNA
和蛋白质组表达分析了
196
例
HCC
病例。该研究的图片摘要见下图。
通过全基因组测序,发现有12,136个基因带有非沉默突变,其中26个基因通过MutSigCV算法被确定为显著突变基因(significantly mutated genes,SMGs) (详见下图)。在这26个SMGs中,有8个基因之前未被认为是肝癌的驱动基因;其中的2个基因,LZTR1和EEF1A1,带有在其他瘤种中反复观察到的体细胞突变。除了上述26个SMGs,另有2个基因,SF3B1和SMARCA4,由MutSigCV分析显示为接近显著(near significance),且带有其他瘤种中的驱动突变。
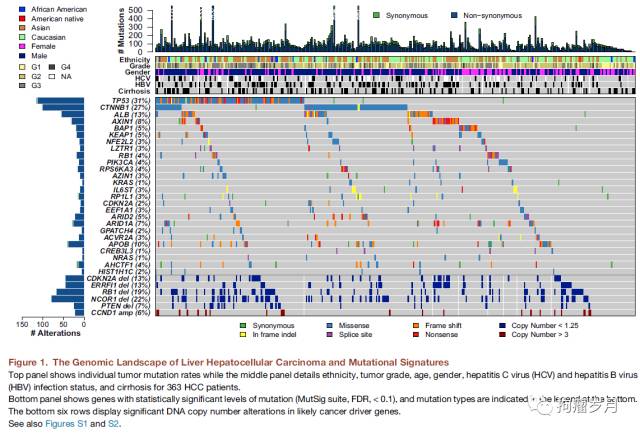
SMGs
中的
ALB
和
APOB
基因是肝细胞分泌血液白蛋白和
VLDL
功能的关键调节因子,这些功能占用了肝细胞转录、翻译和能量消耗的很大部分。另外,研究者还观察到高比例的肝癌带有
CPS1
超甲基化伴
RNA
表达降低,这可能导致谷氨酰胺被分流用于起始嘧啶的从头合成。研究者认为肝细胞恶变为肝癌细胞的过程的关键步骤之一可能是通过遗传
(ALB, APOB)
或表观遗传
(CPS1)
或其他机制进行代谢重编程,使细胞由支持正常器官功能转而仅支持自身的生长和分裂。
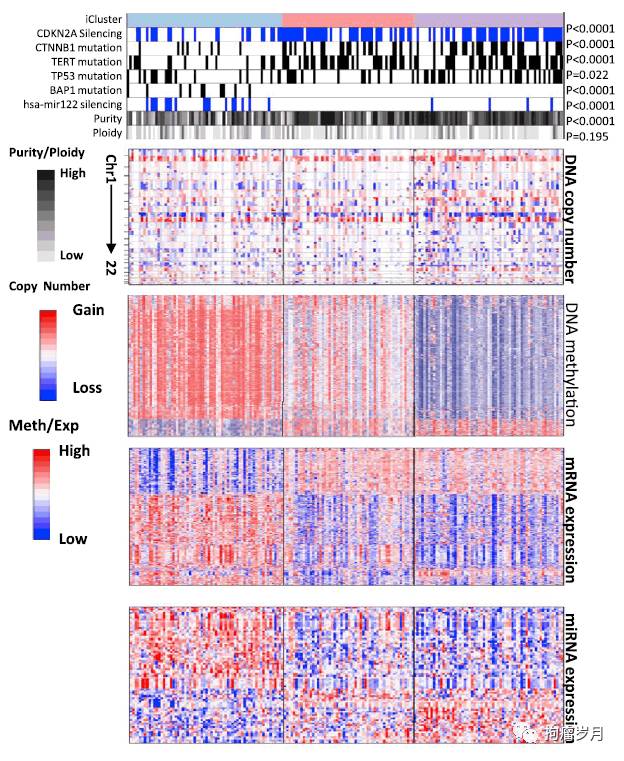
研究者通过综合分子分型,整合了五个数据平台
(DNA
拷贝数、
DNA
甲基化、
mRNA
表达、
miRNA
表达、反向蛋白芯片
(RPPA))
的无监督聚类,确定了肝癌的三个分子亚型
(
见下图
)
:
iCluster1 (iC1)
、
iCluster2 (iC2)
和
iCluster3 (iC3)
。
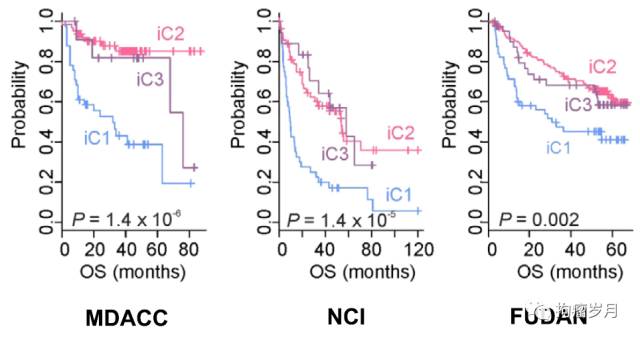
研究者基于基因表达建立了上述分子分型的预测模型,并在
3
个已发表的带有临床注释和长期随访数据的外部肝癌患者队列的数据集上进行测试,发现
iC1
比
iC2
和
iC3
具有显著更差的预后
(
见下图
)
。
本研究中发现了一系列潜在的治疗靶点
TP53
基因在本研究中是肝癌中最常见的
SMG
,在
31
%的肿瘤中突变。目前正在开发的
TP53
活性靶向恢复策略,可能对这些肿瘤有效。此外,研究人员发现一些具有正常
TP53
基因的肿瘤表现出
TP53
低表达且另一基因
MDM4
过度表达。
MDM4
的蛋白质产物与
TP53
蛋白结合并阻断其活性。
MDM4
蛋白目前已有小分子抑制剂。
本研究中发现
CTNNBB1
突变在
27
%的肿瘤中存在,是发生率仅次于
TP53
的
SMG
。
CTNNBB1
是目前正在研发的
Wnt
信号通路抑制剂的靶点。
本研究中,在高达
44
%的肿瘤中发现
TERT
启动子突变。这些突变与端粒延长增加相关。
TERT
启动子突变也与
CDKN2A
基因的沉默强烈相关,
CDKN2A
基因是一种抑癌基因,其蛋白产物有助于调节细胞周期。这两个变异都有助于肝癌细胞的永生性
(immortality)
,而正在进行临床试验的端粒酶抑制剂可能有助于扭转这种永生性。
除了上述的TP53、MDM4、CTNNBB1以及端粒酶,其他潜在的治疗靶点包括:MET,VEGFA,MCL1,IDH1
。
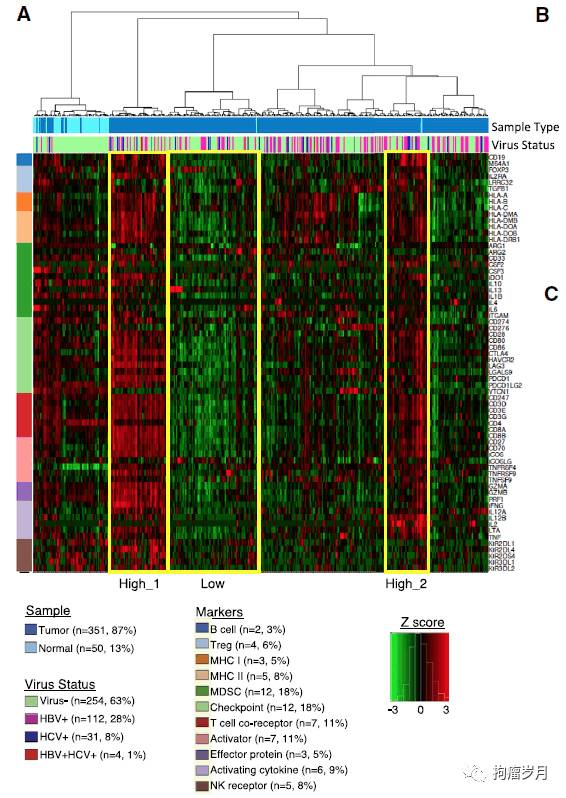
此外,对
196
例肝癌患者的组织病理学分析发现,
22%
的肿瘤具有高或中等水平的淋巴细胞浸润。通过
66
个免疫标志物基因表达的无监督聚类鉴别出了
6
类肿瘤标本,其中
High 1
和
High 2
类显示包括
CTLA4
、
PDCD1 (PD-1)
和
CD274 (PD-L1)
在内的免疫标志物高表达
(
见下图
)
。这提示可能有部分患者对免疫治疗敏感。
TCGA
项目为理解肿瘤的分子特点和指引未来的研究方向提供了丰富而坚实的基础性数据。在本次发表的肝癌的数据中,相当部分患者具有一个甚至可能更多的潜在治疗靶点。肝癌的明天即将大不一样。
一点花絮:在本项重要研究中,使用了一个来自
复旦大学中山医院
的患者队列分别对肝癌分子分型和
IDH1/2
突变的预后作用进行了验证,并标注为
”FUDAN”
。详见原文
Figure 3C
和
Figure 4C
。
本文转载自 拘瘤岁月 ,如有侵权请联系删除。

 生信圈
生信圈





