摘
要:
目的
研究附子
-
干姜对慢性溃疡性结肠炎(
ulcerative colitis
,
UC
)小鼠肠黏膜微循环障碍的改善作用。
方法
建立慢性
UC
小鼠模型,给予附子
-
干姜水煎液进行干预,记录各组小鼠体质量、大便性状及便血情况,进行疾病活动指数(
disease activityindex
,
DAI
)评分;采用激光多普勒血流仪检测各组小鼠肠黏膜血流灌注量、血细胞移动速度和移动血细胞浓度;采用
ELISA
法检测各组小鼠血清中血小板活化因子(
platelet activatingfactor
,
PAF
)和组织因子(
tissue factor
,
TF
)水平;采用苏木素
-
伊红(
HE
)染色法观察各组小鼠结肠组织病理改变情况;采用免疫组化法检测各组小鼠肠黏膜毛细血管内皮细胞
CD31
表达并计算微血管密度(
microvessel density
,
MVD
)。
结果
与对照组比较,模型组小鼠
DAI
评分显著增加(
P
<
0.01
),肠黏膜血流灌注量、血细胞移动速度显著下降(
P
<
0.01
),肠黏膜移动血细胞浓度显著升高(
P
<
0.01
),血清
PAF
、
TF
水平显著升高(
P
<
0.01
),结肠组织
CD31
表达减少,肠黏膜微血管密度显著减少(
P
<
0.01
);与模型组比较,附子
-
干姜高剂量(
6.06 g/kg
)组小鼠
DAI
评分明显降低(
P
<
0.01
),肠黏膜血流灌注量、血细胞移动速度显著升高(
P
<
0.01
),肠黏膜移动血细胞浓度显著降低(
P
<
0.01
),机体凝血因子
PAF
、
TF
水平显著降低(
P
<
0.01
),肠黏膜
MVD
显著增加(
P
<
0.01
)。
结论
附子
-
干姜可通过改善肠黏膜微循环障碍从而治疗慢性
UC
。
溃疡性结肠炎(
ulcerativecolitis
,
UC
)是一种与炎症相关的慢性结直肠疾病,病变呈连续性。目前认为慢性
UC
的发病机制主要为先天免疫和适应性免疫,以及遗传因素与微生物和环境因素之间的相互作用
[1]
。慢性
UC
发病率在全球范围内呈上升趋势,患者病理表现为腹痛、腹泄、黏液血便等症状,生活质量受到严重影响
[2]
。
UC
患病率的增加会增加结直肠癌患病风险。慢性
UC
患者血液呈高凝状态,血栓形成风险高,易导致肠黏膜微循环障碍,进而介导和放大肠黏膜损伤炎症,表明慢性炎症与微循环障碍之间存在着密切联系
[3-4]
。因此改善肠黏膜微循环障碍可能是治疗慢性
UC
的有效方法。
中医认为慢性
UC
属
“
泄泻”“久痢”“休息痢”“肠癖”等范畴,病位多以大肠
为主,涉及脾、胃、肝、肾等脏腑,病理因素常伴有阳虚、血虚、气滞、血瘀等证。慢性
UC
病机多以脾肾阳虚为主,久病不愈、阳气已虚致使气血不足、血瘀肠络,治疗多加用炮姜、熟附子温补脾肾、温通经脉
[5-8]
。因此,中医认为慢性
UC
与血瘀之间存在密切关系
[9]
。
附子为毛茛科植物乌头
Aconitum carmichaelii
Debx.
的子根的加工品,具有回阳救逆、补火助阳、温阳通脉的功效,其性刚烈迅捷、走而不守,能通上达下、行表彻里、通行十二经脉,破癥坚、积聚、血瘕等
[10-13]
。附子无姜不热,常与干姜配伍使用
[14]
。二者配伍在临床上常可治疗慢性肠炎、克隆恩病、慢性胃炎等慢性疾病。课题组前期研究发现
[15]
,
制附子与干姜配伍对肾上腺素所致小鼠耳廓微循环障碍具有良好的改善作用。现代药理学研究表明,附子与干姜配伍具有改善微循环、增加血流速度、提高血流量的作用
[16-17]
。本研究采用葡聚糖硫酸钠(
dextran sulfate sodium salt
,
DSS
)制备慢性
UC
模型,观察附子
-
干姜对慢性
UC
小鼠血清血小板活化因子(
platelet activatingfactor
,
PAF
)、组织因子(
tissue factor
,
TF
)的水平以及肠黏膜微血管密度(
microvessel density
,
MVD
)、肠黏膜血流灌注量、血细胞移动速度、移动血细胞浓度的影响,为附子
-
干姜防治慢性
UC
肠黏膜微循环障碍提供依据。
1
材料
1.1
动物
SPF
级雄性
C57BL/6
小鼠
60
只,
6
~
8
周龄,体质量
20
~
22 g
,购自甘肃中医药大学实验动物中心,合格证号
SCXK
(甘)
2015-0002
,饲养于甘肃中医药大学实验动物中心
SPF
级动物房,温度
18
~
22
℃,相对湿度
50%
~
60%
。动物实验经甘肃中医药大学实验动物伦理委员会批准(批准号
2019-195
)。
1.2
药材
制附子购自河北安草堂药业有限公司,干姜购自河北百合药业有限公司,经甘肃中医药大学药学院中药鉴定教研室李成义教授分别鉴定为毛茛科植物乌头
A. carmichaelii
Debx.
的子根的加工品、姜科植物姜
Zingiber officinale
Rosc.
的干燥根茎。
1.3
药品与试剂
固本益肠片(
0.32 g/
片,批号
20191203
)购自沈阳绿洲制药有限公司;
DSS
(批号
D7002900
)购自上海翊圣生物有限公司;小鼠
PAF ELISA
试剂盒(批号
20200909A
)、小鼠
TF ELISA
试剂盒(批号
20200909A
)购自上海酶联生物有限公司;
CD31
抗体(批号
25u3337
)购自美国
Affnity
公司;
4%
多聚甲醛通用组织固定液(批号
XS190204
)购自北京白鲨易科技有限公司;人尿粪隐血测定试剂盒(批号
H-F01
)购自南京建成生物工程研究所。
1.4
仪器
台式电热恒温鼓风干燥箱(上海精宏设备公司);包埋机(浙江省金华市科迪仪器);切片机、
DM2500
显微镜(德国
Leica
公司);
SHA-C
水浴锅(江苏荣华公司);
iMark
酶标分析仪(美国
Bio Rad
公司);
MoorVMS-LDF
激光多普勒血流仪(英国
Moor Instruments
公司);
Biofuge Stratos
高速冷冻离心机(美国科峻仪器公司)。
2
方法
2.1
附子
-
干姜提取液的制备
根据课题组前期研究
[15]
,附子
-
干姜比例为
1
∶
1
,称取附子、干姜各
100 g
,附子加
10
倍量水浸泡
1 h
,先煎
1 h
,再与干姜合煎
30 min
,滤过;连续煎煮
3
次,合并
3
次滤液,于水浴锅上浓缩至
200 mL
,质量浓度为
1g/mL
(以生药量计),于
−
20
℃保存。
2.2
分组
、
造模与给药
小鼠适应性饲养
1
周后,随机分为对照组、模型组、固本益肠(
1.16 g/kg
)组及附子
-
干姜高、中、低剂量(
6.06
、
3.03
、
1.51 g/kg
)组,每组
10
只。对照组小鼠给予饮用水,其余各组连续给予
2% DSS
水溶液
5 d
,自第
6
天开始自由饮用水
5 d
,此为
1
个循环,如此反复进行
3
个循环,共
30 d
,建立小鼠慢性
UC
模型
[18]
。附子
-
干姜提取液以蒸馏水稀释至质量浓度为
0.30
、
0.15
、
0.08 g/mL
的溶液,分别用作附子
-
干姜高、中、低剂量组;固本益肠片溶于无菌蒸馏水配制成质量浓度为
0.06
g/mL
的溶液。第
31
天各给药组
ig
相应药物(
20 mL/kg
),对照组与模型组
ig
等体积生理盐水,
1
次
/d
,连续
10 d
。每天观察各组小鼠精神状态、饮食、饮水情况,记录小鼠体质量、大便性状及便血情况,进行疾病活动指数(
disease activity index
,
DAI
)评分。体质量下降率评分标准:
0
分为体质量不变;
1
分为下降
1%
~
5%
;
2
分为下降
6%
~
10%
;
3
分为下降
11%
~
15%
。大便性状评分标准:
0
分为正常;
2
分为大便松散;
4
分为稀便。便血评分标准:
0
分为正常;
2
分为潜血阳性;
4
分为肉眼血便。
DAI
=
(
体质量下降率评分+大便性状评分+便血评分
)/3
2.3
附子
-
干姜对慢性
UC
小鼠肠黏膜血流灌注量
、
血细胞移动速度和移动血细胞浓度的影响
小鼠末次给药后禁食不禁水
1h
,
ip 4%
水合氯醛麻醉,将小鼠仰卧固定于实验台,在腹正中线作
2
~
3 cm
切口,暴露结肠,选择距肛门
2
~
4 cm
处为下端观察区,
4
~
6 cm
处为上端观察区,排除剧烈振动、心跳和呼吸对实验的影响。在暴露肠断面覆以纱布,用温盐水湿润,然后将光纤探头轻轻放
在观察区结肠表面,稳定
5 min
后进行观测。取
10 s
的平均值,在检测开始
15 s
时记录血流灌注量、血细胞移动速度和移动血细胞浓度。将观察区上下端所测得的值取平均值作为整个结肠的血流灌注量、血细胞移动速度和移动血细胞浓度值。
2.4
附子
-
干姜对慢性
UC
小鼠血清中
PAF
和
TF
水平的影响
小鼠末次给药后禁食不禁水
1h
,眼眶取血,
3000r/min
离心
10 min
,收集血清,按照试剂盒说明书检测小鼠血清中
PAF
和
TF
水平。
2.5
附子
-
干姜对慢性
UC
小鼠结肠组织病理变化的影响
小鼠末次给药后禁食不禁水
1h
,脱颈椎处死,取结肠组织,清洗后于
4%
多聚甲醛中固定
48 h
,脱水、常规石蜡包埋、切片,附于高黏附载玻片上,于
37
℃过夜,苏木素
-
伊红(
HE
)染色,于显微镜下观察结肠组织损伤变化。
2.6
附子
-
干姜对
慢性
UC
小鼠肠黏膜
MVD
的影响
取各组小鼠结肠组织,清洗后于
4%
多聚甲醛中固定,脱水、常规石蜡包埋、切片。石蜡切片脱蜡后,加入
3% H
2
O
2
阻断内源性氧化酶并用枸橼酸抗原修复
15 min
,
5%BSA
封闭
30 min
,滴加一抗(
1
∶
100
),
37
℃复苏
35 min
,
PBS
洗涤
5 min
,滴加生物素化的二抗,
37
℃孵育
30 min
,
PBS
洗涤
5 min
;滴加辣根过氧化物酶标记的链霉卵白素工作液,
37
℃孵育
30 min
;
DAB
显色、苏木素复染、梯度乙醇脱水、二甲苯透明、封片后,于显微镜下观察并拍照。
CD31
阳性表达呈棕褐色或棕黄色颗粒。在
100
×
视野下观察组织切片,选择
3
个肠黏膜绒毛上微血管较多处,即热点区;再于
200
×视野下计数热点区微血管数目,求
3
个视野的平均值,作为肠黏膜绒毛组织的
MVD
[19]
。
2.7
统计处理
采用
SPSS 23.0
软件分析,实验数据以
表示,采用单因素方差分析(
One-way ANOVA
)进行各组间差异比较。
3
结果
3.1
附子
-
干姜对
慢性
UC
小鼠
DAI
评分的影响
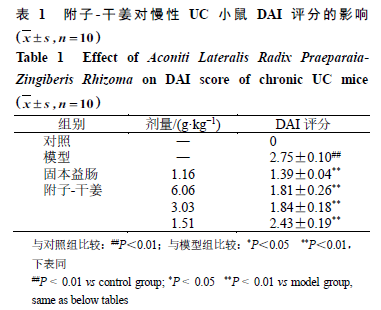
如表
1
所示,与对照组比较,模型组小鼠
DAI
评分显著增加(
P
<
0.01
);与模型组比较,各给药组
DAI
评分显著降低(
P
<
0.01
)。
3.2
附子
-
干姜对慢性
UC
小鼠结肠组织病理变化的影响
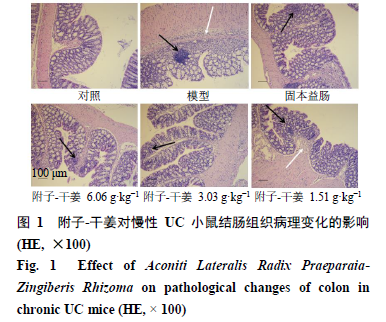
如图
1
所示,与对照组比较,模型组小鼠结肠黏膜炎性细胞浸润明显,腺体排列损伤严重,层次不清,肠上皮细胞再生严重、淋巴组织异常增生。各给药组小鼠结肠组织结构趋于完整,杯状细胞明显增多,炎性细胞浸润明显减少,腺体结构趋于完整,增生组织明显较少。
3.3
附子
-
干姜对
慢性
UC
小鼠
肠黏膜血流灌注量
、
血细胞移动速度和移动血细胞浓度的影响
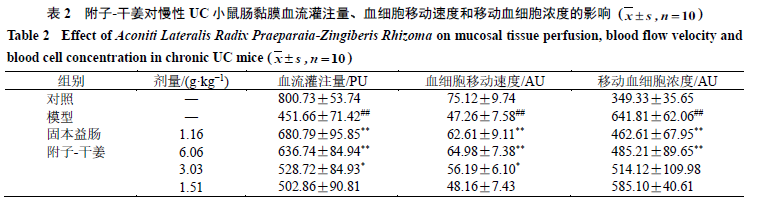
如表
2
所示,与对照组比较,模型组小鼠肠黏
膜血流灌注量、血细胞移动速度显著下降(
P
<
0.01
),移动血细胞浓度显著升高(
P
<
0.01
)。与模型组比较,固本益肠组、附子
-
干姜高剂量组小鼠
肠黏膜血流灌注量、血细胞移动速度显著升高(
P
<
0.01
)、移动血细胞浓度显著下降(
P
<
0.01
);附子
-
干姜中剂量组小鼠肠黏膜血流灌注量、移动血细胞速度显著升高(
P
<
0.05
)。
3.4
附子
-
干姜对
慢性
UC
小鼠
血清中
PAF
和
TF
水平的影响
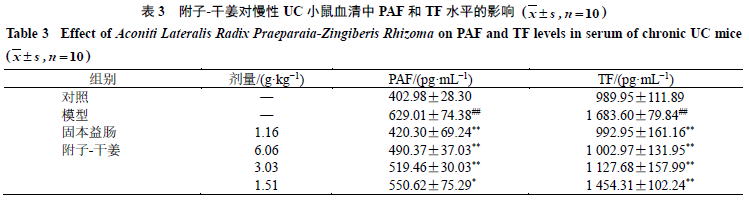
如表
3
所示,与对照组比较,模型组小鼠血清中
PAF
和
TF
水平显著升高(
P
<
0.01
);与模型组比较,各给药组小鼠血清中
PAF
和
TF
水平均显著降低(
P
<
0.05
、
0.01
)。
3.5
附子
-
干姜对
慢性
UC
小鼠
肠黏膜
MVD
的影响
如图
2
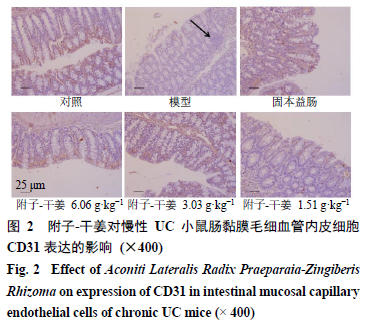
所示,
CD31
阳性表达均定位于血管内皮细胞胞质,呈棕褐色颗粒或棕黄色。对照组小鼠肠黏膜结构清晰,
CD31
表达阳性的棕褐色颗粒分布于肠绒毛的中轴,数量较多;模型组小鼠肠黏膜结构及肠绒毛可见边缘缺损,炎性细胞浸润明显,
CD31
表达阳性的棕褐色颗粒在肠绒毛的中轴分布不均,颗粒较少;各给药组小鼠肠黏膜可见较多的棕褐色颗粒。