Claudin(CLDN)作为人体正常组织中紧密连接的一种重要蛋白质,通常在细胞间紧密连接内表达,以形成调节细胞渗透性的屏障的细胞黏附分子。其具有4个跨膜结构域,主要参与机体生理过程如细胞旁通透性和电导的调节,其次构成了细胞旁屏障,控制着细胞间分子的流动。
Claudin18是CLDN蛋白家族中的重要一员,其中Claudin18.1主要在肺部表达。Claudin18.2在多种肿瘤中高表达,如胃癌、胰腺癌等,Claudin18.2在正常生理状态下仅低水平表达于已分化的胃壁细胞,有望成为胃癌的重要靶点。
 CLDN18.2结构模式图
CLDN18.2结构模式图
目前针对CLDN18.2的相关药物研发百花齐放,包括单克隆抗体(mAb)、双特异性抗体(BsAb)、抗体药物偶联物(ADC)、嵌合抗原受体T细胞(CAR-T)免疫疗法和纳米抗体(Nanobodies,VHHs)等。
多款Claudine18.2在研ADC药物处于临床1/2期及更高阶段。
图:部分临床阶段Claudine18.2在研ADC药物CMG901
CMG901,由Claudin 18.2特异性抗体通过可裂解连接子与毒性载荷单甲基澳瑞他汀E(MMAE)偶联而成。是中国及美国首个取得临床试验申请的Claudin 18.2 ADC药物, 在临床前研究中便显示出了强大的抗肿瘤活性。
作用机制:
①CMG901可通过特异结合Claudin 18.2阳性细胞,内吞进入细胞溶酶体,释放MMAE,进而导致肿瘤细胞的细胞周期停滞,进而诱发细胞凋亡。
②CMG901可激活免疫防御,通过ADCC和CDC效应杀伤Claudin 18.2阳性细胞。
2024 ASCO大会上,徐瑞华教授携CMG901(AZD0901)数据亮相,在CLDN18.2高表达晚期经治胃癌患者中,该药物展现出较好的抗肿瘤活性和安全性。2.2mg/kg剂量组,确认ORR 48%,中位PFS 4.8个月,中位OS达11.8个月。
IBI343
IBI343是一款抗体-依喜替康偶联物(ADC)。
作用机制:IBI343(CLDN18.2 ADC),与表达CLDN18.2的肿瘤细胞结合后, ADC内化,并释放毒素药物引起DNA损伤,导致肿瘤细胞凋亡,药物具有旁观者效应。
2024 年 ESMO Asia(欧洲肿瘤内科学会亚洲年会),IBI343(CLDN18.2 ADC)治疗晚期胰腺导管腺癌临床I 期数据亮相。
相关研究的43 例患者(60.5%患者为三线及以上)的ORR 为32.6%,cORR 为23.6%,cDCR 为81.4%,mPFS 为5.3 个月,mPFS 超出现有三线疗法的mPFS(约2 个月)。
LM-302
LM-302由Claudin 18.2 特异性抗体、可裂解连接子、以及毒素载荷甲基澳瑞他汀E(MMAE)组成的ADC药物
2022年5月5日授权与美国Turning Point (已被美国BMS公司收购)公司,达成总价值11亿美元的License Out交易
2024年上半年,LM-302的Ⅲ期临床试验在ClinicalTrials.gov平台上登记启动,用于治疗CLDN18.2阳性局部晚期或转移性胃及胃食管结合部腺癌。
SHR-A1904
恒瑞医药开发的SHR-A1904是一款拥有知识产权的Claudin18.2靶向ADC药物,其有效载荷是拓扑异构酶抑制剂(TOPOi)。2024年初,恒瑞医药子公司收到了国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准阿得贝利单抗注射液,联合注射用SHR-A1904和化疗用于晚期实体瘤。2024年欧洲肿瘤内科学会(ESMO)大会,恒瑞医药SHR-A1904中山大学肿瘤防治中心徐瑞华教授公布了一项SHR-A1904用于Claudin18.2(CLDN18.2)阳性的胃癌/胃食管结合部腺癌(GC/GEJC)患者的初步数据。Ⅰ期临床研究中,SHR-A1904在Claudin18.2阳性的胃癌/胃食管结合部腺癌患者群体,展现较好的安全性和疗效。药物在6.0mg/kg剂量组显示出良好的耐受性,其客观缓解率达到了55.6%,疾病控制率为88.9%。
此外,恒瑞医药与德国默克已签订了高达14亿欧元的合作协议,默克获得SHR-A1904在中国大陆以外的全球独家开发等权利。
SHR-A1904的1b期研究为评估其耐受性和安全性并确定3期临床剂量,3期临床将评估其与化疗和免疫一线治疗相比的疗效。
ATG-022
ATG-022由抗Claudin 18.2单抗,通过仅细胞内裂解的连接子与可诱导细胞凋亡的毒素偶联而成,具有旁杀伤效应。ATG-022对Claudin 18.2有低纳摩尔级别的高亲和力,且具有强效的体内,以及体外抗肿瘤活性。
2023年3月14日,德琪医药公告称,ATG-022的一期临床试验获国家药监局批准,用于评估ATG-022单药的安全性及耐受性,以确认ATG-022的生物有效剂量、最大耐受剂量和二期试验的使用剂量。其适应症为治疗晚期及转移性实体瘤。
2024ASCO年会,德琪披露了ATG-022在一项针对晚期实体瘤患者的I 期探索研究,包括剂量递增阶段以及剂量扩展阶段。
通过规定的最大耐受剂量和/或推荐的 2 期剂量,进一步评估ATG-022 的安全性、耐受性和有效性。ATG-022该研究的其它终点:药代动力学 (PK) 和药物活性的探索性生物标志物。
RC118
RC118是荣昌生物的第4款ADC药物, 由抗人 Claudin 18.2 抗体通过连接子与微管抑制剂MMAE偶联而成,其Claudin 18.2 抗体部分为引进的祐和医药的Claudin 18.2单克隆抗体。
作用机制:ADC与Claudin 18.2受体形成的复合物,内吞进入细胞,被转运至溶酶体,溶酶体中的组织蛋白酶B裂解二肽连接子,释放出MMAE,MMAE与微管结合,使细胞阻滞在G2/M期,最终诱导靶细胞凋亡。
2021年7月,RC118在澳洲开展Ⅰ期临床试验(针对Claudin18.2表达阳性患者的局部晚期不可切除或转移性恶性实体瘤),其适应症为“标准治疗无效或无法耐受标准治疗的局部晚期不可切除或转移性恶性实体肿瘤”。
2021年9月,1类新药注射用RC118获国家CDE的I期临床试验批件,并在剂量爬坡研究,表现出一定的安全性与耐受性。RC118为国内申报临床的第3款Claudin 18.2 ADC产品。
2022年12月,RC118获得美国FDA颁发的两项孤儿药资格认定,适应症分别为:胃癌(含胃食管交界癌)和胰腺癌。
2023年4月,RC118联合PD-1单抗疗法,获得CDE批准,在Claudin18.2表达阳性局部晚期不可切除,或转移性恶性实体瘤进行Ⅰ/Ⅱa期临床研究。
SKB315
SKB315是靶向Claudin 18.2的第三代ADC药物,结构包括:PH敏感性的可裂解连接子、新型的DNA抑制剂毒素,其DAR值7-8。
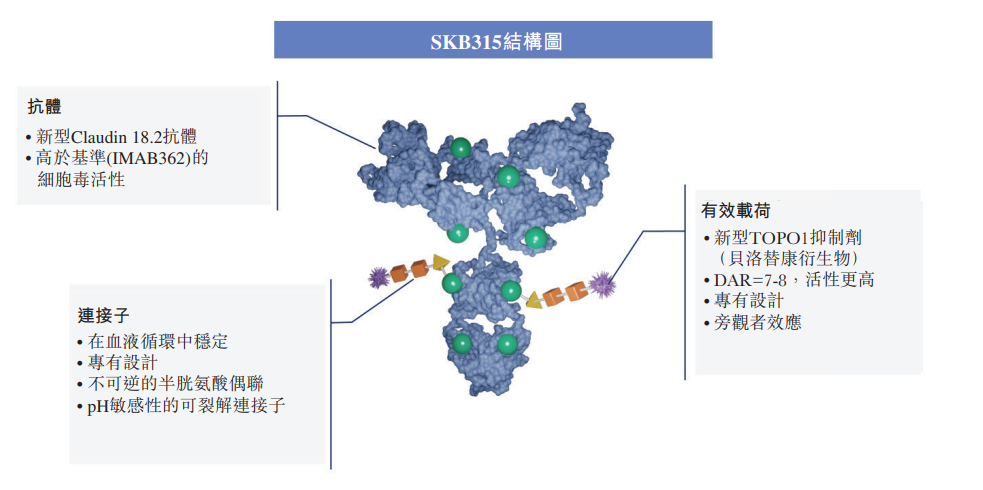
2022 年7 月,SKB315得到默沙东青睐,通过3500万美元首付款+累计不超过9.01亿美元里程碑付款及销售提成的价格,获得SKB315 的全球权利。然而,2024年8月19日,默沙东退还了已进入临床阶段的ADC SKB315的权益。
XNW27011
XNW27011是信诺维开发的一款靶向CLDN18.2的抗体偶联药物(ADC),XNW27011在临床前及临床试验显示良好的抗肿瘤疗效,在胃癌、胰腺癌等多种实体瘤研究中,展现出了良好抗肿瘤活性,及安全性。2022年12月30日,XNW27011获得FDA的默示许可,开展I期/II期临床试验。适应症为局部晚期不可切除或转移性恶性实体瘤。2023年4月21日,注射用XNW27011获国家CDE批准临床试验,适应症为晚期实体瘤。2024 年 6 月 14 日,信诺维宣布XNW27011 获 FDA 快速通道资格(Fast Track Designation, FTD),其适应症为胃癌。识别微信二维码,添加生物制品圈小编,符合条件者即可加入
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。















