
作者:V. Greenwood
编译:二宗主(“原理”公众号)
当温度高于一定程度,细胞便会坏死。
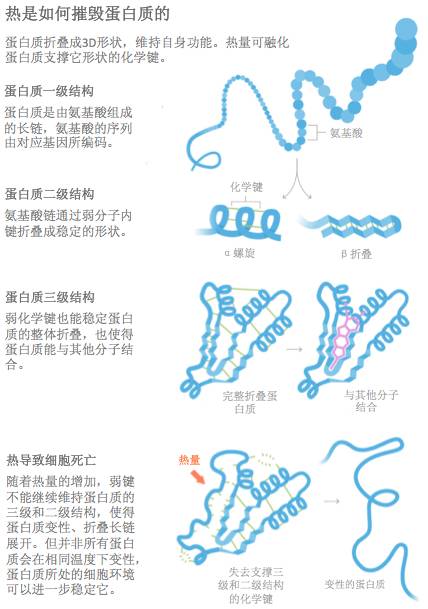
生命所必需的那些蛋白质通常具有十分精准的形态,
它们以长链的形态开始,根据其分子序列,折叠成螺旋状、片状、或其他形状,这些形状在保证蛋白质的功能上发挥了巨大的作用。然而,当温度开始升高时,维持蛋白质结构的
化学键会遭到破坏
:先从较弱的开始,随着温度的升高,更强的化学键也不能幸免。这也解释了
细胞为何缺乏耐热性。我们知道
蛋白质结构的大面积损伤是致命的,但直到最近,我们才搞清楚过高的温度是否、以及如何杀死细胞的。
最近,瑞士苏黎世ETH的生物物理学家们研究了四种不同的生物体的细胞中的蛋白质在温度升高的环境下的表现。研究结果表明,当一个细胞因为温度升高而死亡时,其中只有
少数关键蛋白质会解体
,无论这些蛋白质是来自人类细胞还是大肠杆菌。此外,蛋白质在细胞中的
丰度
与蛋白质的
稳定性
还显示出迷之相关性。这项研究让我们对管理蛋白质排序和紊乱的基本规则有所了解,从这些规则中,研究人员意识到,它们的意义远远超出了探究为什么热能导致细胞死亡的问题。

△ 生物学家Paola Picotti,此次实验的领导者
(图片来源:Quanta Magazine)
领导这项研究的生物物理学家保拉·皮科蒂(Paola Picotti)解释说,实验源自于一个古老而棘手的问题:
为什么有些细胞能在高温下生存,而有的却会死亡?
嗜热栖热菌能在温泉中幸福生活,在家用热水中也能茁壮生长,而大肠杆菌在高于40°C的环境下就得歇菜。这些现象都强力里的证明了
不同生物体的蛋白质的稳定性有明显差异
。
对蛋白质进行研究是的最理想的方式是在活细胞中,但这并非易事。
再者,在试管中分离蛋白质只能得到部分答案,不像在生物体内,蛋白质会相互依偎、改变彼此的化学属性或帮助彼此维持正确的形态。因此,要了解蛋白质是如何解体的,还需在蛋白质与蛋白质能相互影响期间对其进行观察。
△ (图片来源:Lucy Reading-Ikkanda/Quanta Magazine)
为了解决这个问题,Picotti的研究团队设计了一个巨大的自动化工作流程,它们能分离细胞,并对其内容物进行逐步加热,每个阶段都有
蛋白质切片酶被
释放。这些酶特别适用于非折叠蛋白质的切片,因此研究人员可以通过查看蛋白质在逐次升温过程中分解的片段来判断。以这种方式,他们绘制了上千种不同蛋白质的展开和变性曲线,这些曲线显示了它们从舒适温度下的完整结构到温度升高后的变性状态的转变弧度。
为了了解这些曲线在不同物种间的差异,他们对人类、大肠杆菌、嗜热链球菌和酵母等四种物种的细胞进行了研究。
最清楚的发现之一是,在每种物种中,
升温并没有导致大量蛋白质呈集体展开的趋势
。相反,他们观察到
只有一小部分蛋白质很早就分解了
,而且这些都是关键的蛋白质。在蛋白质相互关系网中,这些脆弱的少数蛋白质通常是高度相关的,这意味着它们对细胞中的许多反应都有影响。 没有这些蛋白质细胞就不能正常运作,当它们消失时,整个蛋白质网络就很可能崩溃,从而结束细胞的生命。
这是否就像是个悖论呢?
最重要的蛋白质却是最脆弱的。
如果一种蛋白质具有多重作用,它可能从某种不稳定、易展开、重折叠的特性中获得优势,因为这可以使它能具备任意形状来适合下一个目标。 Picotti解释说:“许多这些关键蛋白质中都具有高度的灵活性,这使得它们更加不稳定。”但是它可能使它们具有多种功能,可以与细胞中的各种目标分子结合。用Picotti的话来说: “这可能就是它们具备执行多项功能所需做出的牺牲吧。”
通过更仔细地观察大肠杆菌,研究人员还发现了蛋白质的丰度与稳定性之间的关系 。据报道,
细胞复制的蛋白质越多,破坏蛋白质所需的热量就越多
。蛋白质的丰度和坚固性之间的这种关系,与芝加哥大学的生物学家Allan Drummond在十多年前提出的有关细胞蛋白质有导致机械性的随机误差产生的倾向。一个错误通常会破坏蛋白质的稳定性,如果它是一种常见的蛋白质,则每天有成百上千的细胞会产生这种蛋白质,那么这些带有错误信息的大量复制品就可能将细胞填满,这种蛋白质的聚集对细胞来说可能是致命的。





