2018年4月6日,韩国Celltrion公司宣布收到FDA针对其两种BLA申请产品(CT-P10和CT-P6)的完整回应信(Complete Response Letters),FDA拒绝了这两款药物的上市申请,CT-P10和CT-P6分别是在研的针对利妥昔单抗(Rituximab)和曲妥珠单抗(Trastuzumab)的生物类似药。
根据Celltrion网站的声明,FDA要求提供关于两种产品的补充信息。Celltrion表示将与监管机构密切合作,解决导致收到完整回应信的问题,并希望在一年内获得FDA批准这两种药物。业界猜测美国FDA拒绝这两个生物类似药上市申请的决定可能跟药物的临床无关, 更多的可能与这家韩国制药商去年收到了FDA的483表格有关,该表格提到了违反cGMP的12个观察结果,包括记录不完整、设备设计不合理、环境监测不足,以及灭菌过程验证不充分等细节问题。
虽然这两款抗体类似药遭到拒绝并不是由大家更为关心得相似性问题引起,但仍然给近几年来激流勇进的抗体类似药研发敲响了警钟,业界对此消息也颇为意外,况且
CT-P10已在欧洲上市两年多。
事实上自2012年以来,随着众多重磅抗体药物专利期临近,抗体类似药一度成为生物制药研发领域最热门的领域,从彼时各大学术会议的主题也可见一斑。2013年欧盟批准全球首个抗体生物类似药CT-P13(
Celltrion的infliximab类似药
)更是进一步助力类似药研发,大小药企纷纷加入抗体类似药研发。此趋势至
2015年达到顶峰,当年
国内也正式
出台了
生物类似药指导条例,抗体类似药逐渐回归理性的节奏。时至今日,当人们进一步平衡
生物类似药研发的收益与研发难度,基于市场环境的考量,同时受制于PD-1等创新药物研发的刺激后,生物类似药的研发热度正在淡去。如果不是此次FDA拒绝
Celltrion的两款药物,
或许
人们早已经习惯于类似药的高成功率了。
这几年
生物类似药的浮沉,或许代表的不是技术的迭代,而是激变中的药物研发环境。然而无论是创新药还是类似药,对于药企都是需要获得更高的回报,对于病人来说都是更可及化的先进治疗。站在如此角度,让我们共同回顾这几年抗体类似药的沉浮岁月。
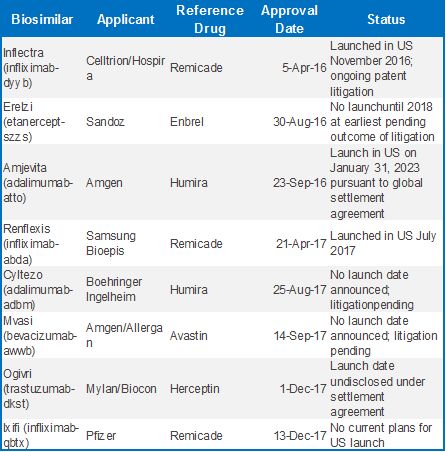
截止到2017年底,FDA和EMA共分布批准8个和11个抗体类似药品种。EMA一向在药物监管上更为大胆,2013年即批准首个抗体生物类似药。而FDA直到2016年才批准第一个抗体类似药,随后FDA似乎对抗体类似药的监管开了窍,接连批准了多个药物,并且在2017年批准了首个抗肿瘤的生物类似药。从两个地区批准的药物来看,主要集中在Remicade,Enbrel,Hurima,Avastin和Herceptin这五个产品,
Remicade的类似药研发最为集中,更为奇特的是Pfizer在收购Hospira后拥有了Celltrion的
Remicade的类似药,同时其自己的
Remicade类似药也在2017年底得到批准。
▲FDA批准抗体类似药
从欧美两地批准
的
抗体类似药列表看上,或许仍然是一份不错的答卷,但是现实情况来看,两地的市场环境仍有极大的差异。美国批准的8款抗体类似药中,仅有
Remicade类似药得以上市,其它均由于专利期或其它问题均未上市销售。并且基于FDA可交换性的思路考量,仍然给多个品种的大规模销售带来挑战。欧洲批准的11款
抗体类似药则均实现了顺利销售,虽然在欧洲各国的情况仍然有些差异。对于以上几款药物,美国市场占据60%以上的销售比例,因此很长时间美国对于类似药研发企业仍然充满诱惑,但是挑战重重。
基于生物类似药的广阔前景,市场估值一路走高,根据BARCLAYS银行2017年一项市场报告预测,所有的生物类似药在2017年的市场总量将达到23亿美元,同期每年将会以35%的复合增长率增长,到2022年时有望突破百亿美元大关。虽然这是对所有生物类似药销售的一番估测,但是抗体类药物仍然会占据较大的份额,市场空间依旧很大。
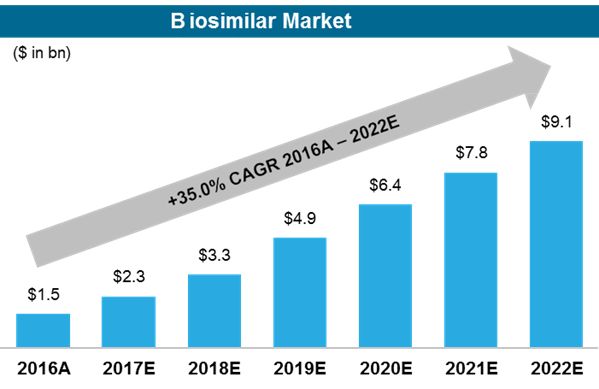
▲生物类似药市场预估
根据目前全球几家抗体类似药研发领先企业的财报来看,市场情况还是较为复合预期的。
Biogen 2017年生物类似药全年销售额达到3.8亿美元,年增长率达到270%。Biogen的合作伙伴Samsung biologics虽然没有透露2017年生物类似药具体销售额,但是根据总体业绩以及2016年数据,预估2017年其生物类似药销售额将到达4.416亿美元,增长率为220%。Celltrion 2017年销售额达到8.89亿美元,增长率达到41.5%。诺华旗下的Sondoz的类似药2017年全年达到11亿美元,年增长率为12%,当然这不仅仅包含抗体类似药,但是抗体类似药的增长率更高一些。从目前这几个抗体类似药的领先企业的数据来看,市场的特殊性仍然存在,欧洲市场增长率更高一些,据透露
Celltrion的利妥昔类似药
CT-P10已经占据英国80%的市场份额。
目前生物类似药在欧洲和美国形成截然不同的情况,一方面是监管的原因,另一方面则是专利方面的原因。从目前的情况来看,欧洲整体上的专利布局更为简单一些,或者说原研厂家基本是“不抵抗政策”。而在美国,原研厂家仍然在进行最后抗争,先有Amgen的潜水艇专利直接将Enbrel美国专利延长至2029年。后有
AbbVie
关于Adalimumab的70多项核心制剂专利,一路将专利延长至2022年,并且多家公司的挑战并未成功。
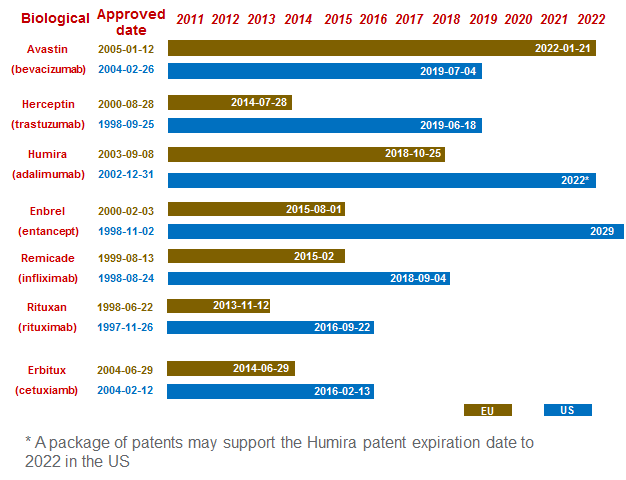
▲生物类似药专利布局
然而,重攻之下AbbVie也慢慢变得妥协。4月5日,AbbVie宣布与Samsung Bioepis就阿达木单抗生物类似物的专利侵权诉讼在全球范围内达成和解。AbbVie将会就其持有的专利权利授予Samsung Bioepis非独家的许可权。根据协议,在美国市场,Samsung Bioepis从AbbVie获得的专利许可自2023年6月30日起生效,而在大多数欧盟国家,该许可在2018年10月16日起即可生效。Biogen/Samsung Bioepis的阿达木单抗类似物Imraldi已经在2017年8月获得了欧盟批准,但尚未在美国批准。Biogen/Samsung Bioepis将按照协议向AbbVie支付未来的产品销售分成。
去年9月28日,AbbVie曾宣布与Amgen就阿达木单抗的专利诉讼达成全球和解,Amgen在美国市场获得的阿达木单抗专利许可自2023年1月31日起生效。
受制与追赶心理,基于市场竞争的考虑,近两年抗体类似药的热度在国内逐渐降温。2017年CDE全年共接收76项抗体类药物IND申请,其中一类新药达到43项,占比达到56.5%,标志着国内抗体药物逐渐由仿制药向创新药转型。
面对类似药的浮浮沉沉,就当药企们在类似药和创新药来回犹豫时,有的选手已经即将到达冲刺终点。2017年
10月30日,复宏汉霖研制的利妥昔单抗注射液(重组人鼠嵌合抗CD20单克隆抗体注射液,HLX-01)用于非霍奇金淋巴瘤治疗的上市申请(CXSS1700026)获得CFDA药品注册审评受理,2018年有望成为国内首个严格意义上的生物类似药。
致力于“可及化创新”的复宏汉霖,近年来一直深耕于老百姓用得起的抗体药物研发过程中。
中国的生物类似药监管政策文件《生物类似药研发与评价技术指导原则(试行)》在2015年2月28日方才正式出台,但是复宏汉霖从HLX01立项之初就严格按照欧盟的质量标准开展药学研究,因为药学、毒理学方面的资料比较扎实,复宏汉霖在2014年3月获得了CFDA签发的HLX01用于治疗非霍奇金淋巴瘤(NHL)的I~III期临床大批件(即临床I、II、III期试验一起批准),距离递交临床申请不到2年时间,这在当时注册申请积压比较严重的情况下已经算是非常快速的了。
从2009年开始到现在,
复宏汉霖
坚持按照国际质量标准进行药学质量对比,并与原研药做头对头的比较研究,目前也是为数的不同多个项目进行全球多中心研究的公司。
十三五重大新药创制项目中,复宏汉霖作为组长单位牵头、领导十三五抗肿瘤生物类似药重大专项,这一殊荣和复宏汉霖在抗体生物类似药研发实力雄厚是分不开的。
带着在生物类似药开发的上的深厚经验,
复宏汉霖的CEO
刘世高
博士将在协会第二届年会上带来“Development of biosimilars in China”的演讲,分享抗体生物类似药开发的经验。同时刘博士也将作为panelist,参与中国抗体药申报美国IND的机遇与挑战的
深入讨论
(
中国抗体药申报美国IND: 机遇与挑战
)
,
届时欢迎您来到年会现场与刘博士进行交流。

Dr.Scott Liu, President and CEO of Shanghai Henlius Biotech Inc., has a Ph.D.degree in biology from Purdue University. Dr. Liu was a key member of the CMC teams for the late-phase development and commercial cGMP manufacturing of Orencia and Vectibix. Because of hisoutstanding achievement, Dr. Liu has won the Bristol-Myers Squibb Company'sTech Ops President Award. Liu Scott has 21 years of experience in biopharmaceutical R&D, regulatory affairs and quality operations, and he was awarded the title of "1000 Expert of Shanghai" in 2013. At the same time, Dr. Liu assisted the formation of “Quality Alliance of Protein Therapeutics” and helped the CDE of CFDA in the establishment and improvement ofthe quality standards for protein therapeutics in China. He also took the lead to promote an industry-wide adoption of single-use technologies into clinical and commercialization of manufacturing of monoclonal antibody drugs; and actively participated in the development of
《
Technical Guidelines of Biosimilar Development and Evaluation
》
to promote the innovation and globalization of the biopharmaceutical industry of China. Under his leadership, Henlius has successfully developed and moved into clinical trials six mAb therapeutics (including one innovative mAb), and the first two of which are in phase 3 trials. Henlius has also successfully built a commercial biologics manufacturing facility in Shanghai in 2016, and obtained an EU QP’s declaration of GMP for conducting the clinical trials of its first four biosimilar products in Europe.























