BioArt按
:
在慢性感染或癌症发生过程中,持续性的抗原刺激或炎症信号导致T细胞效应功能的抑制,通常称之为
T细胞“耗竭
(exhaustion)”【1】。处于耗竭状态的T细胞细胞因子应答降低、细胞毒作用减弱,同时伴随着表面
抑制性受体
( Inhibitory Receptors, IRs)表达上调。表面抑制性受体作为
免疫检查点
(Immune-checkpoint)调控T细胞的效应功能。通过阻断免疫检查点来恢复耗竭T细胞的功能在癌症和慢性感染治疗中备受关注,并临床上取得了不错的效果,但大部分患者对免疫检查点阻断无应答是该领域面临的最大挑战【2】。目前对免疫检查点阻断无应答的分子机制还不明确。6月29日
Cell
杂志在线发表了圣犹达儿童研究医院
Ben Youngblood
团队
题为“
De Novo Epigenetic Programs Inhibit PD-1 Blockade-Mediated T Cell Rejuvenation
”的
研究论文。
该研究团队发现,在持续性的淋巴脉络丛脑膜炎病毒(LCMV)感染过程中,通过抑制De Novo DNA甲基转移酶Dnmt3a能够抑制活化的CD8 T细胞中新生DNA甲基化,从而维持持续性病毒感染中CD8 T细胞的效应功能,并在Tramp-C2肿瘤模型中得到了验证。该研究论文提出了新生DNA甲基化是调控T细胞耗竭和免疫检查点阻断治疗无应答的重要因素。免疫检查点阻断和新生DNA甲基化抑制相结合,为癌症和慢性感染治疗提供新的思路。

论文解读:
癌症和慢性感染性疾病是人类面临的重大健康问题,其中癌症的治疗是人类面临的最大难题。PD-1阻断治疗来回补耗竭CD8 T细胞功能成为治疗癌症和慢性感染最为有效的方法之一。但
目前的研究发现,很大一部分患者对PD-1阻断治疗无应答,可能存在某种细胞内源性的分子机制影响PD-1介导的T细胞功能的回补
。Ben Youngblood团队发现了T细胞耗竭相关的DNA甲基化是影响PD-1阻断治疗的重要因素。
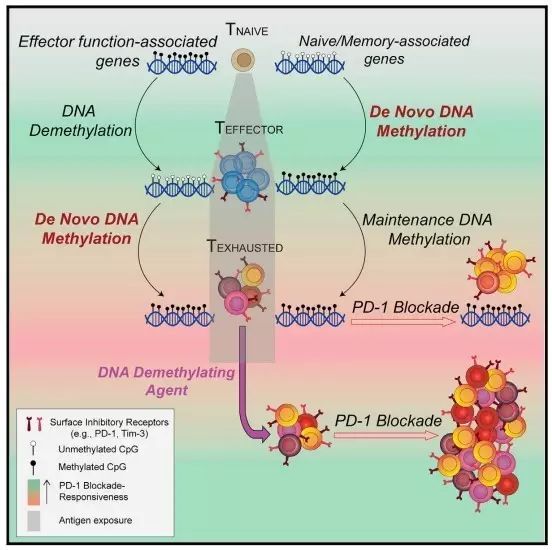
最近的研究表明,CD8 T细胞从naïve向effector分化过程中,表型和功能的改变与全基因组DNA甲基化编程的改变密切相关【3】。那么,CD8 T细胞的耗竭是否受新生DNA甲基化的影响呢?该研究利用全基因组重亚硫酸盐测序(Whole-genome bisulfite sequencing, WGBS)的方法比较了WT和Dnmt3a条件性敲除小鼠在慢性淋巴脉络丛脑膜炎病毒(LCMV)感染下,naïve、effector和exhaustion三个不同阶段的CD8 T细胞全基因组甲基化水平。结果表明,
相比较于naïve阶段,effector CD8 T细胞具有多达10000个去甲基化区域,WT CD8 T细胞比Dnmt3a cKO CD8 T细胞多了约980个新生甲基化区域,这一结果也证明了CD8 T细胞效应分化过程中伴随着大量的表观遗传修饰的改变
。同时,研究人员比较了effector向exhaustion转化过程中CD8 T细胞全基因组的甲基化水平,WT CD8 T细胞较Dnmt3a cKO小鼠CD8 T细胞多了1200个Dnmt3a介导的DNA甲基化区域,并且这些甲基化区域大部分集中在效应功能、细胞增殖相关基因区域,如
IFNγ、Tcf7、Myc
。
为了证明新生DNA甲基化是否影响了PD-1阻断介导的T细胞功能的复苏?anti-PD-L1抗体的处理显著增加了慢性感染的WT小鼠抗原特异性的CD8 T细胞,但
IFNγ
、
Myc
区域DNA甲基化水平并没有改变。相比于WT小鼠,慢性LCMV感染的Dnmt3a cKO小鼠PD-1阻断处理后具有较高比例的抗原特异性的CD8 T细胞和较高的细胞因子应答(IL-2、IFNγ)。同样的结果在经典的Tramp-C2肿瘤模型中得到了验证,肿瘤浸润的PD-1hi CD8 T细胞
IFNγ、Myc、Tcf
区域高度甲基化,同时给予PD-1阻断和DNA去甲基化试剂DAC处理增加了肿瘤浸润的CD8 T细胞的增殖,肿瘤的生长得到显著性抑制。
该研究揭示了T细胞耗竭过程中伴随着大量的新生DNA甲基化,新生DNA甲基化编程可能是影响PD-1阻断治疗无应答的潜在分子机制。这一研究成果为免疫检查点阻断治疗提供了新的思路。
值得注意的是,在对于anti-PD1治疗反应性不同的肿瘤类型(黑色素瘤,结肠癌等)中,是否存在新生DNA甲基化和anti-PD1治疗反应性的负向相关性值得进一步探讨,另外,作为一个临床使用的化疗药物,DAC的作用是否只是通过去甲基化来增强肿瘤浸润的CD8 T细胞的功能还有待进一步研究。
这项工作的为表观治疗联合免疫治疗检查点阻断治疗提供了新的理论基础和思路
。值得一提的是,当前FDA批准的DNA去甲基化试剂,例如地西他滨(decitabine),不仅可以直接靶向于肿瘤细胞,在另一个层面,可直接作用于上述过程,限制CD8 T细胞exhanstion过程中的DNA甲基化修饰, 从而增强anti-PD-1/L1的反应性和治疗效果。所以在不同靶细胞中,该药物抗肿瘤上的作用效果是一致的。另外有意思的是, 在T细胞抗肿瘤效应中,由Tet家族介导的DNA去甲基化过程同样扮演非常重要的作用.多个研究发现,在T细胞激活过程中Tet2及DNA 5羟甲基化修饰表达下调。2016年Nature报道,S-2-羟戊二酸可以竞争抑制Tet2的功能,能增强T细胞增殖和抗肿瘤的能力(Tyrakis et al., 2016)。未来如何更好的认识T细胞activate、differentiate、exhaustion过程中的甲基化和去甲基化的修饰及潜在作用, 是靶向T细胞表观治疗的一个重要问题。
通讯作者
:Ben Youngblood
,圣犹达儿童研究医院教授,主要从事病毒免疫和CD8 T细胞记忆分化、耗竭及表观遗传调控方面的研究。

通讯作者 Benjamin Youngblood教授(左)及论文第一作者 Hazem Ghoneim博士(右)。图片引自:
ScienceDaily网站
致谢
:
感谢中国科学技术大学
朱书
教授及其研究生
张围桥
,耶鲁大学
潘文
博士以及
王俊
博士对于该篇论文报道的帮助。
参考文献:
1. Wherry, E.J. (2011). T cell exhaus tion.
Nat. Immunol
. 12, 492–499 .
2. Sha rma, P., and Allison, J.P. (2015a). The future of immune checkp oint ther-apy.
Science
348, 56–61.
3. Sch arer, C.D. , Barwick, B.G., Yo ungblood, B.A., Ahmed, R., and Boss, J.M.(201 3). Glo bal DNA methylatio n remode ling accompani es CD8 T cell effector funct ion.
J Immunol
. 191 , 3419–34 29.
4. Ghoneim et al.,De Novo Epigenetic Programs Inhibit PD-1 Blockade-Mediated T cell Rejuvenation,
Cell
170, 1-16.
















