颅颌面骨缺损
因创伤、肿瘤或感染难以自愈,传统治疗手段效果有限。脂肪源性干细胞(ADSCs)因其易获取性和多向分化潜力成为骨组织工程的希望,但其成骨能力不足、细胞存活率低等问题制约临床应用。近年来,
环状RNA(circRNA)
因其稳定性和调控干细胞分化的能力备受关注,但其在ADSCs成骨中的作用机制尚不明确。
如何
通过基因工程增强ADSCs功能,并协同免疫调控与血管生成实现高效骨修复
,是亟待解决的关键问题。

鉴于此,来自
中山大学的邓飞龙,赵玮以及余东升
团队
开发了
circAars工程化ADSCs结合GelMA水凝胶的策略
,通过协同促进成骨分化、巨噬细胞极化和血管生成,加速颅颌面骨缺损修复。
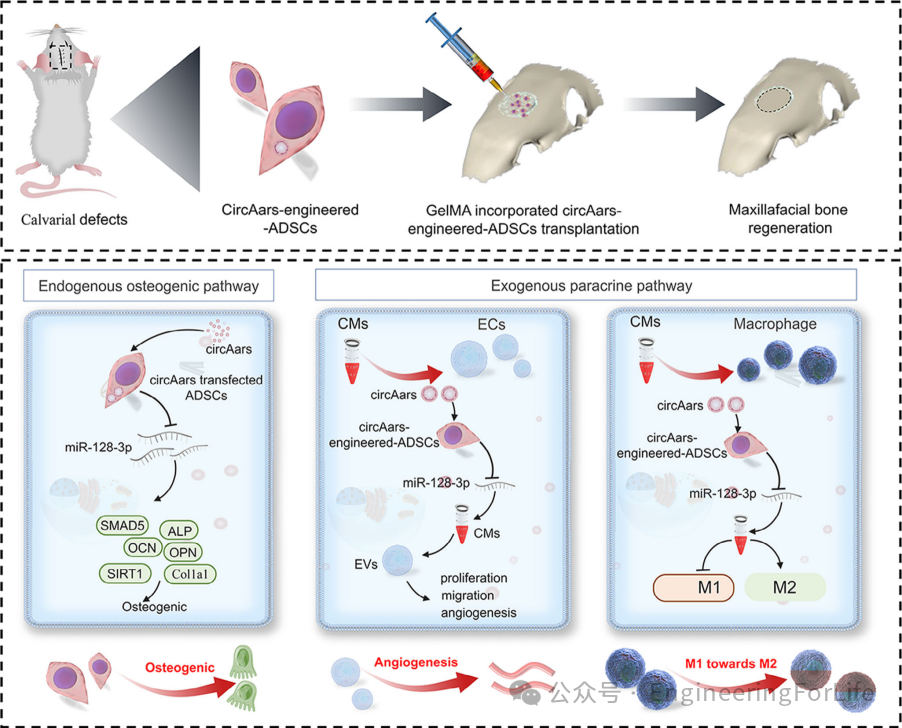
本文要点:
(1)circAars“海绵”miRNA—激活ADSCs成骨潜能:
研究发现circAars通过吸附miR-128-3p,解除其对成骨基因(如BMP2、Runx2)的抑制,显著提升ADSCs的碱性磷酸酶活性、钙结节形成及迁移能力。这种靶向调控机制为增强干细胞成骨功能提供了新思路。
(2)多效调控—免疫-血管-成骨“三管齐下”:
circAars工程化ADSCs通过旁分泌作用,诱导巨噬细胞从促炎M1型向修复M2型极化,同时促进内皮细胞迁移和血管生成。这种“免疫微环境重塑+血管化+成骨”的协同策略,突破了单一调控的局限性。
(3)GelMA水凝胶—细胞存活的“黄金支架”:
研究首次将circAars-ADSCs封装于GelMA水凝胶中,其类细胞外基质特性保障了细胞高活性与形态维持,且缓释的旁分泌因子持续调控局部微环境,最终在动物模型中实现大尺寸骨缺损的高效修复。
本研究首次揭示了
circAars通过miR-128-3p调控ADSCs成骨分化
的分子机制,并创新性地整合免疫调节与血管化功能,为复杂骨缺损修复提供了多维度解决方案。GelMA水凝胶的载体设计进一步提升了细胞治疗的安全性与效率。
未来,或将推动该技术的临床转化,并深入探究circAars在人体干细胞中的调控网络,同时优化水凝胶的力学性能以适应动态骨修复需求。这一策略有望拓展至其他组织再生领域,为再生医学开辟新赛道。
参考资料:
https://doi.org/10.1002/adhm.202404501
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






