2017年6月16日,第十三届上海国际大肠癌高峰论坛在沪成功举办,近千名海内外专家齐聚一堂,由赛生公司主办的2107年结直肠癌免疫治疗研讨会也如火如荼,共讨胃肠肿瘤免疫治疗。 本次研讨会由复旦大学附属中山医院许剑民教授任大会主席,并邀请浙江大学医学院附属第一医院林建江教授作会议主持。会上,来自东南大学医学院 王立新教授介绍了免疫的基础研究“自噬·免疫·肿瘤”,复旦大学中山医院任黎教授阐述了“手术联合免疫治疗在肿瘤治疗中的作用”,最后,解放军总医院戴广海教授介绍了“解放军总医院胃肠肿瘤MDT经验与展望”。
 自噬·免疫·肿瘤
自噬·免疫·肿瘤
东南大学医学院 王立新 教授
自噬是细胞水平的概念,有降解,死亡和分泌3个功能。细胞内有2条蛋白降解途径:泛素蛋白酶体和自噬小体溶酶体,自噬是细胞内2条蛋白降解途径之一。细胞中3种主要的死亡方式:凋亡,自噬和坏死,凋亡主要是caspase通路作用,而自噬主要通过mTOR通路。近年来,发现自噬还有分泌功能,产生分泌型自噬小体。那么:肿瘤细胞能否释放分泌型自噬小体?我们研究团队一直致力于这一研究。我们在多种肿瘤细胞培养上清液中提取并鉴定了肿瘤细胞释放的分泌型自噬小体,将其命名为肿瘤细胞释放自噬小体(Tumor-released Secretory Autophagosome, TRAP)。
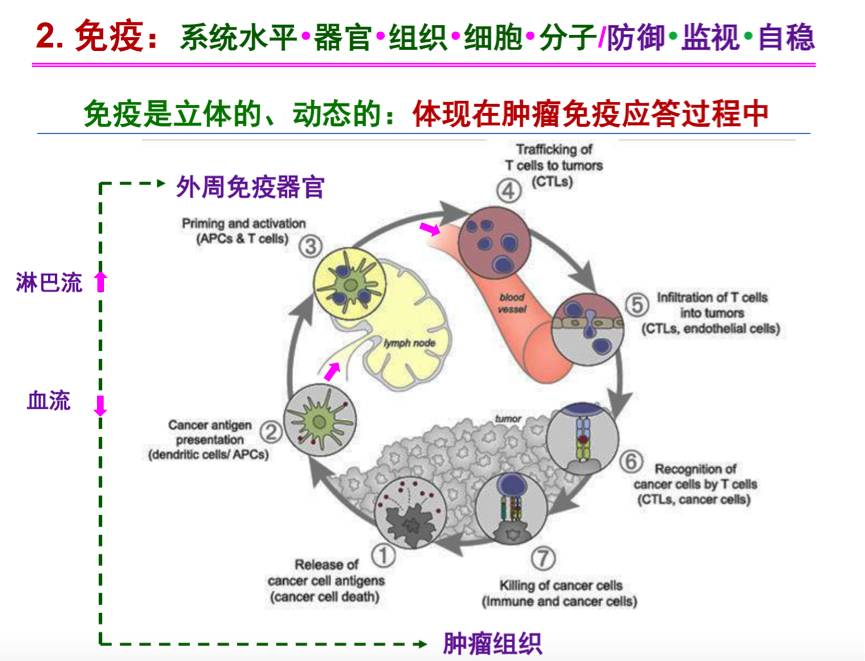
相比于自噬,免疫是系统水平的概念。免疫是立体的、动态的,这也体现在肿瘤免疫应答过程中,如下图所示的免疫活化过程。目前免疫检查点抑制剂是研究的热点。CTLA-4是T细胞表面的跨膜受体,在外周免疫器官参与免疫反应负性调节,使得正常免疫变为超常。而PD-1/PD-L1是肿瘤组织产生的异常抑制机制,应用PD-1/PD-L1抗体治疗中,可以使得低下的免疫变为正常,因此临床上PD-1/PD-L1抗体相比于CTLA-4单抗用于免疫治疗更有前景。
Chen DS, Mellman I. Immunity. 2013;39(1):1-10
肿瘤是组织水平的疾病,肿瘤组织中包括肿瘤细胞,免疫细胞和基质细胞。其中,免疫细胞是肿瘤微环境中重要的组成部分,目前肿瘤细胞与炎症因子、免疫系统的相互作用是极受关注的前沿。2013年,肿瘤免疫治疗被评为10大科学突破之首,此外,PD-1/PD-L1单抗在肿瘤治疗中取得了重大突破。
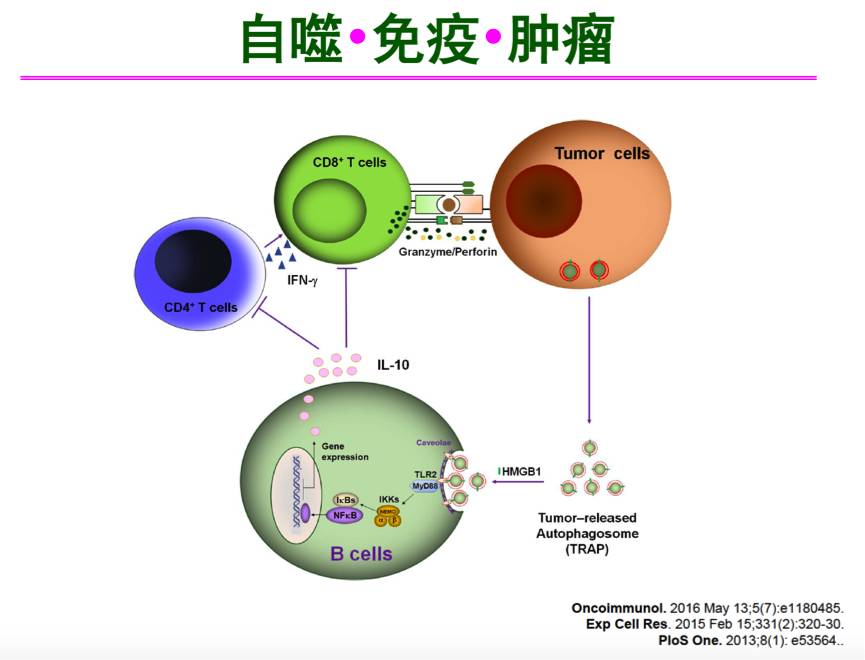
那么自噬和肿瘤有什么关系?首先,两组是不同水平的概念,分别为细胞水平和组织水平。目前的观点认为,自噬对于肿瘤而言是双刃剑,在肿瘤发生早期,自噬起抑制作用,而肿瘤晚期,自噬起促进作用。我们的研究显示,肿瘤细胞在缺氧条件下会释放分泌型自噬小体(TRAP),它表面有一些危险分子,通过B细胞表面的TLR2和MyD88以及NFkB活化B细胞,不是让其产生抗体,而产生IL-10,从而抑制T细胞增殖,达到免疫抑制的作用。
最后,王教授也指出
,
CTLA-4,PD-1/PD-L1是从功能上解除了肿瘤的免疫抑制,而我们也要重视对T细胞整体数量的提升,特别是肿瘤微环境中的T细胞浸润。无数量何谈功能。
 手术联合免疫治疗在肿瘤治疗中的作用
手术联合免疫治疗在肿瘤治疗中的作用
复旦大学中山医院 任黎教授
(一)手术对肿瘤患者免疫功能的影响
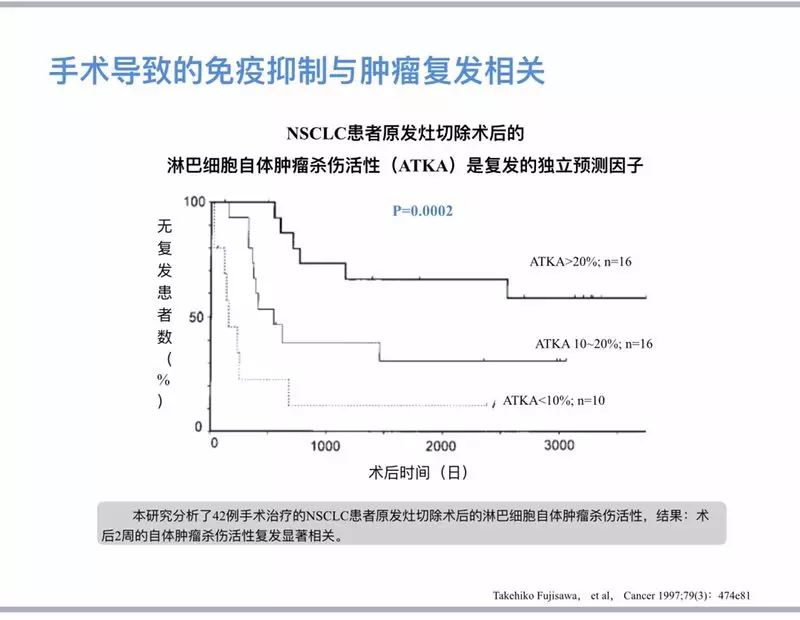
手术是大多数早期实体瘤的标准治疗,在给患者带来巨大获益的同时,也可能带来一些负面影响,例如:手术导致的生理应激可能抑制肿瘤患者的免疫功能,加重免疫抑制状态;并且,手术操作中的机械触碰、切割也会不可避免地导致少量肿瘤细胞脱落,进入血液循环,在免疫抑制的状态下,这些细胞可能在新的地方发生增殖,最后形成肿瘤转移灶。
手术导致的免疫抑制是对患者有多个负面影响:1. 是肿瘤患者术后感染的危险因素;2. 是微转移灶形成的可能原因;3.可能影响到患者的预后;4. 手术导致的免疫抑制与肿瘤复发相关。
 (二)免疫治疗与手术的协同作用
(二)免疫治疗与手术的协同作用
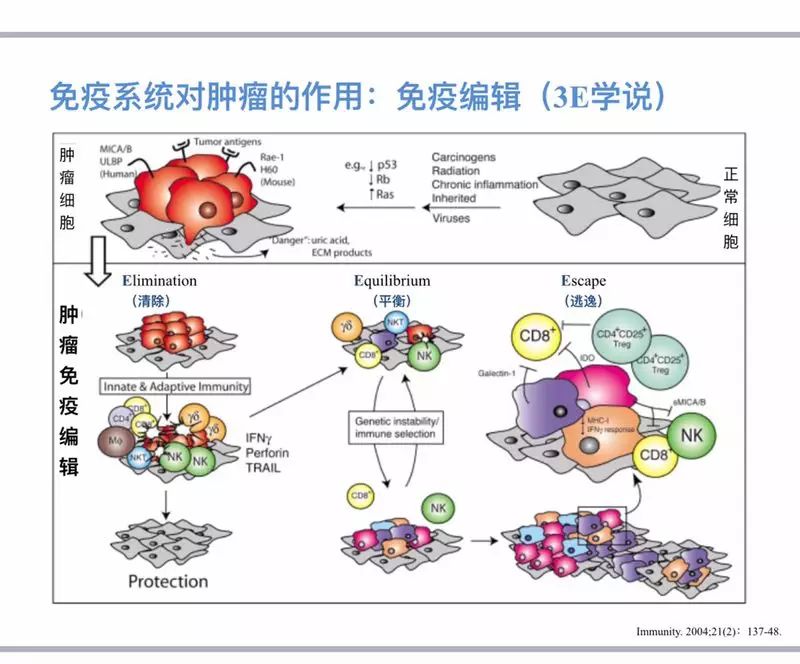
肿瘤的免疫编辑理论认为,免疫系统与肿瘤的相互关系可以分为三种不同的状态: “清除”(Elimilation);“平衡”(Equilibration)和“逃逸”(Escape)。肿瘤免疫治疗利用人体的免疫系统攻击肿瘤,旨在通过调节机体的免疫状态,达到治疗肿瘤的目的。
一方面,手术在降低肿瘤负荷后,可以消除一些免疫抑制因素,如降低骨髓来源抑制性细胞、免疫抑制性细胞因子的含量,这可能是手术增强免疫治疗效果的机制;另一方面,免疫治疗可有效清除微小残留病灶,从而延缓复发。以上,是手术和免疫治疗联用的基础。
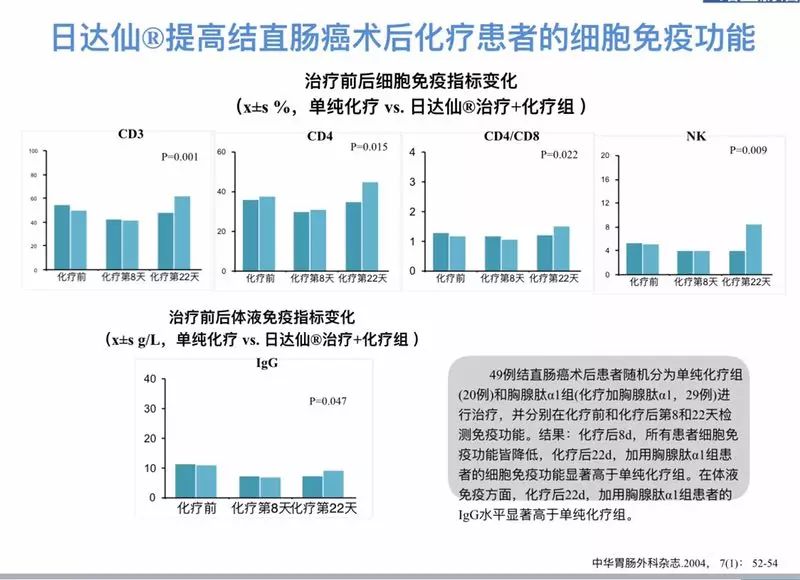 (三)胸腺法新/Tα1(日达仙
®
)的抗肿瘤机制
(三)胸腺法新/Tα1(日达仙
®
)的抗肿瘤机制
胸腺肽α1 是从胸腺组织中分离的天然物质,内源性Tα1可在血清中检测到,健康成人的水平范围为 0.1-1.0ng/mL。胸腺法新/Tα1 的主要成分是化学合成的胸腺肽α1,纯度>99 %。目前,
胸腺法新/Tα1 免疫治疗的机制已研究得比较透彻:通过刺激免疫细胞TLRs,进而激活MyD88和非MyD88信号通路,从而调节免疫应答。胸腺法新/Tα1 对肿瘤细胞的作用可分为间接和直接两个途径。直接作用是指
胸腺法新/Tα1
提高肿瘤细胞表面MHC-1的表达,使肿瘤细胞更易被T细胞识别。间接作用是指 胸腺法新/Tα1 能够增强NK细胞的活性,促进DCs 的活化以提高其递呈肿瘤抗原的能力。增加 CTL 细胞的数量与活性,从而提高机体消灭肿瘤细胞的作用。