1983年,Patlak 和 Blasberg 教授等人发表了用于脑血流研究的数学模型,他们假设示踪剂进入人体后在血浆及其他组织内可以来回穿梭,但最终一定至少有一个腔室可以将示踪剂及其标记的放射性核素捕获在内。如果示踪剂在体内的分布符合上述假设,则经过模型分析后的图像将生成一条直线,其斜率为Ki代表代谢率(influx rate),截距代表血管内及可逆腔室内的示踪剂分布。
1
假设所有可逆腔室均与血浆达到平衡状态,即血浆与可逆腔室中的放射性浓度之比必须保持稳定。在此情况下,只有不可逆腔室内不断累积的放射性浓度会影响表观分布容积(apparent distribution volume)。在临床实践中,平衡状态仅在血浆浓度曲线急剧变化之后才可达到,此时血浆曲线(输入函数)的下降速率已降至足够低,使得组织腔室内与血浆中的放射性浓度保持同步变化。
2
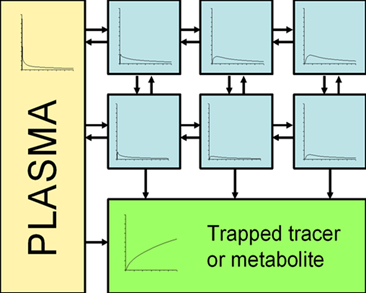
Figure 1 放射性药物注入体内后在多个可逆性腔室中来回穿梭,直到某个时间点之后(达到平衡态),所有可逆腔室的放射性浓度的变化将与血浆内放射性浓度的变化相同(二者之比保持稳定)。在此之后,单位血浆浓度中总组织内的放射性浓度的变化即代表了不可逆腔室内的浓度变化。
2
从1983
年至今,Patlak模型广泛应用于良性及恶性疾病、各个脏器以及多种示踪剂的PET显像定量分析。PET定量分析方法可分为基于体素内放射性浓度的“物理定量 (半定量)”和基于示踪剂参与人体生理过程的“生理定量”。物理定量方法易受多种因素影响,如摄取时间、部分容积效应(PVE)等。生理定量方法相对稳定,可重复性好,并且其生成的代谢率图像可提高病灶检出率、减少误诊率以及生成统一的阈值。
3,4
前面所提到的基于Patlak模型的定量方式就是生理定量方法。
与SUV图像相比,Ki图像具有更高的靶本比(TBR)和信噪比(CNR)。因此,高本底区域(如肝脏)的肿瘤在Ki图像上具有更高的检出率。
4
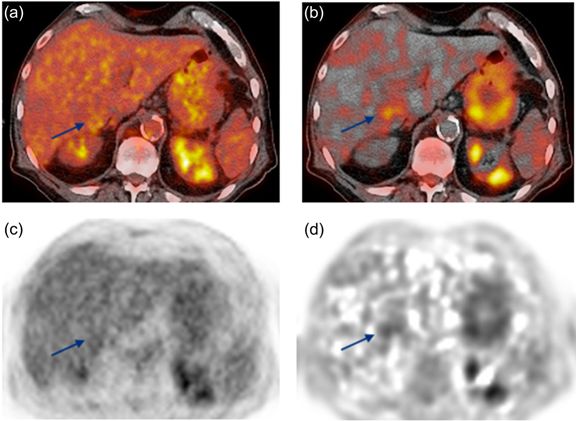
Figure 2 图a. SUV与平扫CT融合图像;
b. Ki与平扫CT融合图像;
c. SUV图像;
d. Ki 图像。
箭头处病灶经穿刺病理证实为HCC。
4
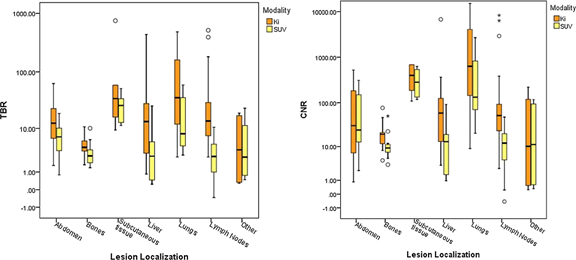
Figure 3 Ki 与SUV 图像相比,无论肿瘤分布在哪个器官,Ki图像的靶本比(TBR)和信噪比(CNR)均比SUV图像高。
4
在
18
F-FDG 显像中,Ki图像反映肺结节葡萄糖代谢率,提高诊断准确性。
4

Figure 4 SUV图像(a,c)上易误诊为恶性结节,Ki图像(b,d)上结节代谢率未见增高。
随后的穿刺活检证实为良性肺结节。
虚线箭头指示主动脉,Ki图像上可见血管壁与血管内游离FDG分界清晰。
4
18




