揭示调控CD8+T细胞功能的机制是癌症研究的主要焦点。流式细胞术和单细胞转录组学的进步为癌症中CD8+T细胞研究提供了前所未有的深度分辨率。然而,这些技术依旧无法很好解决重要的空间信息(在何处),包括细胞间相互作用、组织定位、肿瘤内免疫生态位、三级淋巴结构、肿瘤引流淋巴结等。
CD8 + T细胞具有识别和消除癌细胞的能力。然而,免疫抑制肿瘤微环境中的慢性抗原刺激导致功能失调或“耗竭”表型的发展,不能有效介导肿瘤消除。
免疫检查点阻断虽然极大推动了肿瘤免疫治疗,但在所有癌症类型中,只有~12%的患者有反应。如何以免疫检查点抑制剂为基础,开发更优的临床方案,是后PD(L)1时代的重要策略,但这一切需要更加了解有效CD8 + T细胞抗肿瘤免疫的环境,分子和空间决定因素等。
目前,控制癌症中CD8+T细胞分化轨迹的分子和细胞回路的研究主要集中在肿瘤床( tumor bed)中的细胞。但是T细胞的很多事件发生在肿瘤引流淋巴结(TDLN)以及其他生态位,这部分研究是不足的。
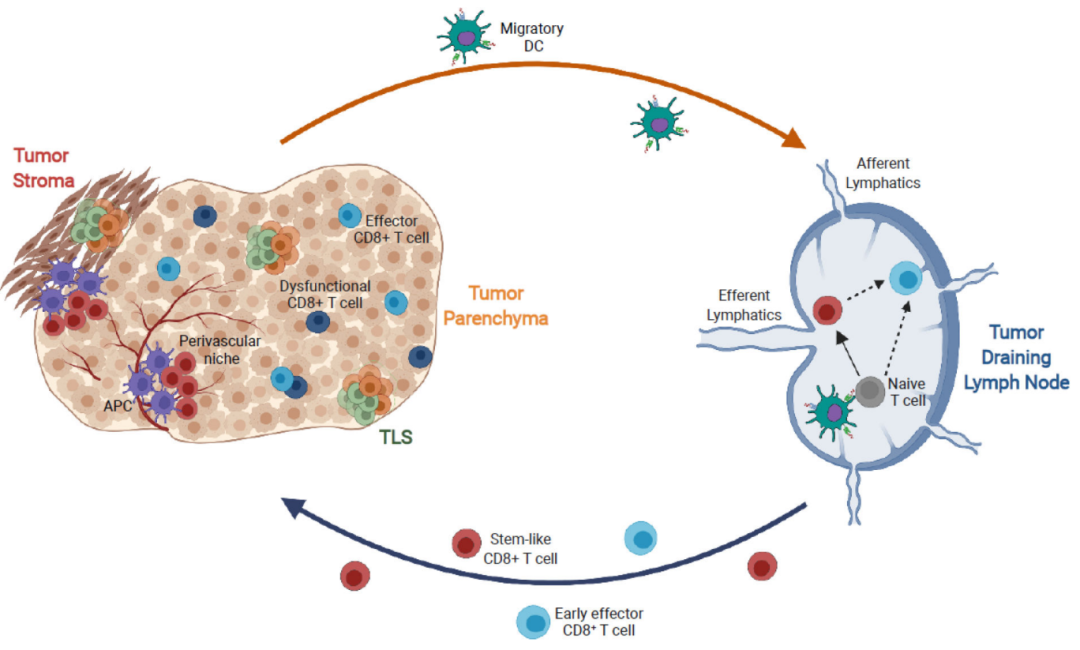
血管周围肿瘤生态位肿瘤
干细胞样CD8+T细胞对于维持抗肿瘤免疫至关重要,尤其使用免疫检查点抑制剂之后。
干细胞样CD8 + T细胞与典型干细胞具有共同特征,包括自我更新,高增殖潜力以及产生更多分化细胞的能力。
干细胞通常存在于特定的生态位中,其中特定的生存信号和支持性细胞类型保持其干性。多项研究揭示了TCF1
+ CD8 +干细胞样 T细胞与抗原呈递细胞(APC)之间的空间相关性。
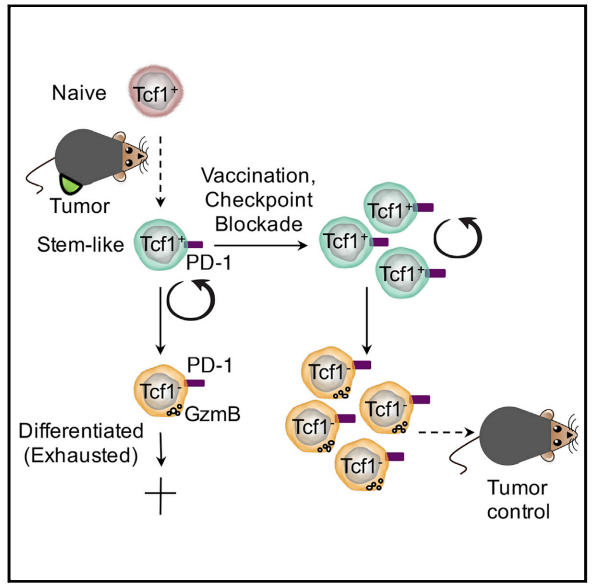
Siddiqui et al., 2019, Immunity 50, 195–211
在肾癌、膀胱癌和前列腺癌中,TCF1+CD8+T细胞的定位富集在MHCII+APCs密集的区域,而TCF1−CD8+T细胞(包括效应细胞和功能失调细胞)位于远端。
值得注意的是,这些生态位的存在与高肿瘤血管化相关。
在黑色素瘤小鼠模型中,TCF1+干细胞样CD8+T细胞优先存在于肿瘤组织内CD31+内皮细胞周围的血管周围区域。
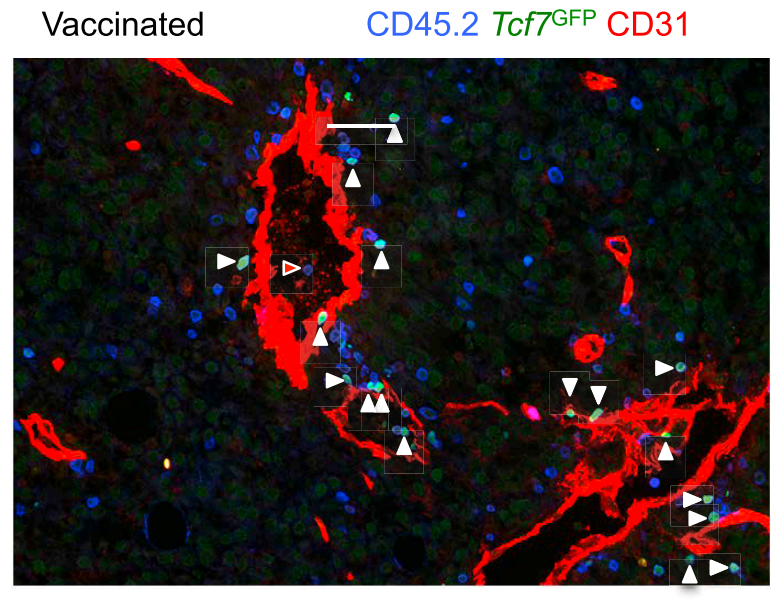
Siddiqui et al., 2019, Immunity 50, 195–211
三级淋巴结构
三级淋巴结构(TLS)是类似于次级淋巴器官滤泡的免疫细胞簇,在许多组织中出现,以响应慢性炎症。在癌症中,TLS既存在于原发性肿瘤中,也存在于淋巴和非淋巴器官的转移中。TLS最常见于肿瘤周围或基质实质边界,但有些也见于肿瘤床内。由于TLS在小鼠模型中很少见,因此研究依赖于人类肿瘤标本。它们通常被鉴定为CD20+或CD19 + B细胞簇。
TLS被认为是增强免疫活性的位点,其中组织结构经过优化以实现有效的免疫细胞相互作用。TLS在癌症中的水平从未成熟到成熟不等,取决于生发中心和分类切换B细胞的存在与否,它们在肿瘤中的发生与CD8+T细胞浸润增加相关。
CD8+ T细胞在卵巢癌、非小细胞肺癌、乳腺癌和黑色素瘤中发现在TLS内部或周围。CXCL13通过CXCR5吸引B细胞和CD4+T细胞,在非小细胞肺癌、黑色素瘤、乳腺癌和肝癌的功能失调的CD8+T细胞中上调。一种可能性,即随着CD8+T细胞功能失调,它们开始表达CXCL13并启动TLS形成,以维持其有限的功能。
Pelka et al., 2021, Cell 184, 4734–4752
肿瘤引流淋巴结(TDLN)是启动新发抗肿瘤反应的关键部位。常规迁移树突状细胞(cDC)的两个亚群cDC1和cDC2可以熟练地摄取肿瘤中的抗原并将其运输到TDLN。一旦进入TDLN,迁移性cDC初始化肿瘤特异性CD8+和/或CD4+T细胞,或将肿瘤抗原转移到常驻DC中,从而激活幼稚T细胞。活化的T细胞然后离开淋巴结参与抗肿瘤反应。
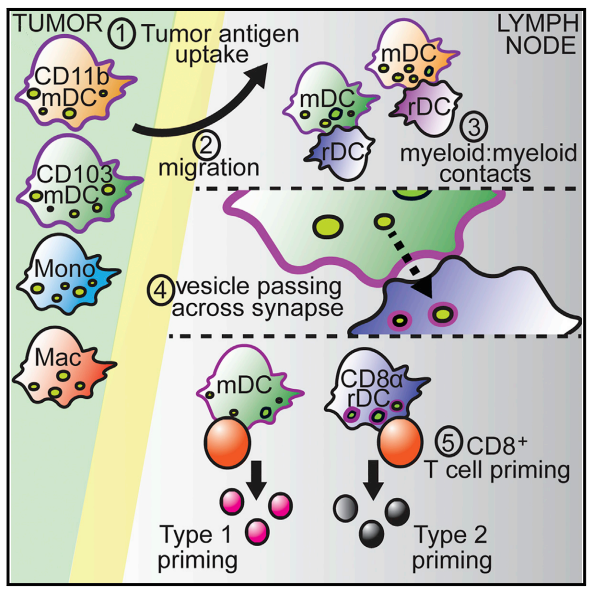
Ruhland et al., 2020, Cancer Cell 37, 786–799
小鼠模型在进行有效免疫治疗后,基于质谱的全身免疫动力学分析,显示肿瘤外多个器官存在广泛免疫重塑(尤其是T细胞),首次强调全身系统免疫对抗肿瘤的贡献。
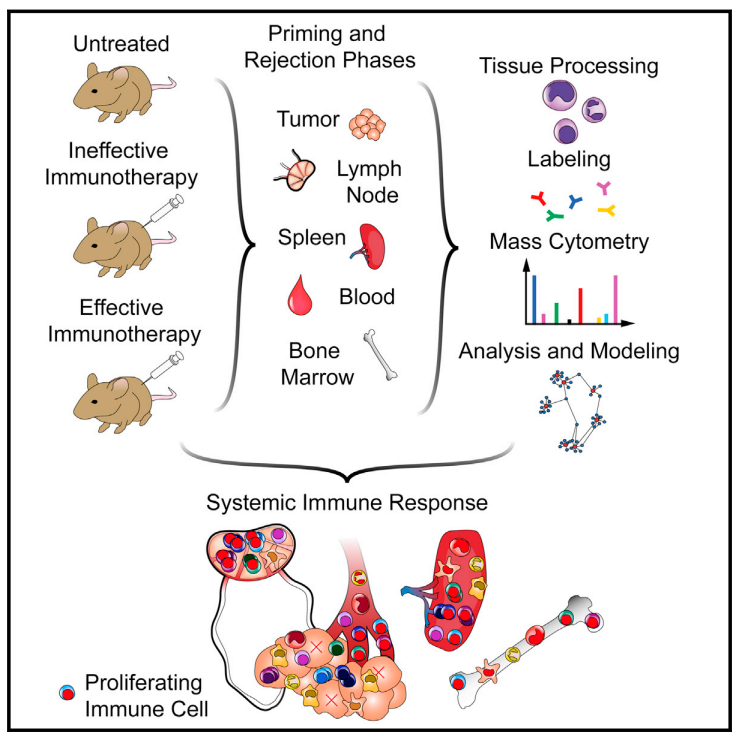
Spitzer et al., 2017, Cell 168, 487–502
简评:CD8 + T细胞研究在癌症中的下一个时代不仅关注“谁”,而且还结合“在哪里”,以便更好地理解和解决“如何”和“为什么”的问题。















