本文来源:
iNature
染色质结构与细胞类型特异性基因调控程序有关,但染色质在发育过程中的重塑仍有待完全阐明。
2019年8月19日,加州大学圣地亚哥分校任兵及Neil C. Chi共同通讯在
Nature Genetics
在线发表题为“
Transcriptionally active HERV-H retrotransposons demarcate topologically associating domains in human pluripotent stem cells
”的研究论文,该研究通过
观察人多能干细胞(hPSC)分化过程中的染色质重组,发现灵长类动物特异性内源性逆转录转座子-人内源性逆转录病毒亚家族H(HERV-H)在hPSC中创建拓扑缔合结构域(TAD)的重要作用
。删除这些HERV-H元件消除了它们相应的TAD边界并减少了上游基因的转录,而HERV-H元件的从头插入可以引入新的TAD边界。
HERV-H产生TAD边界的能力取决于高转录,因为HERV-H元件的转录抑制阻止了边界的形成。这种能力不限于hPSC,因为这些活跃转录的HERV-H元件及其相应的TAD边界也出现在来自其他人的多能干细胞中,但不存在于缺乏HERV-H元件的更远距离相关的物种中。总的来说,
该研究结果为逆转录转座子在积极塑造细胞类型和物种特异性染色质结构提供了直接证据。

染色体的三维组织能够促进增强子和启动子之间的长程相互作用,这对于在多细胞物种中构建复杂的基因调控网络至关重要。
在体细胞中,间期染色体占据称为染色体区域的独立核空间。
每个染色体被组织成一个动态但非随机的分层结构,其特征在于延伸的转录活性,兆碱基长的区室,其中散布着一系列转录无活性的区室。
这些区室可以进一步划分为拓扑结合域(TAD),其表现出高水平的域内相互作用和相对低水平的域间相互作用。
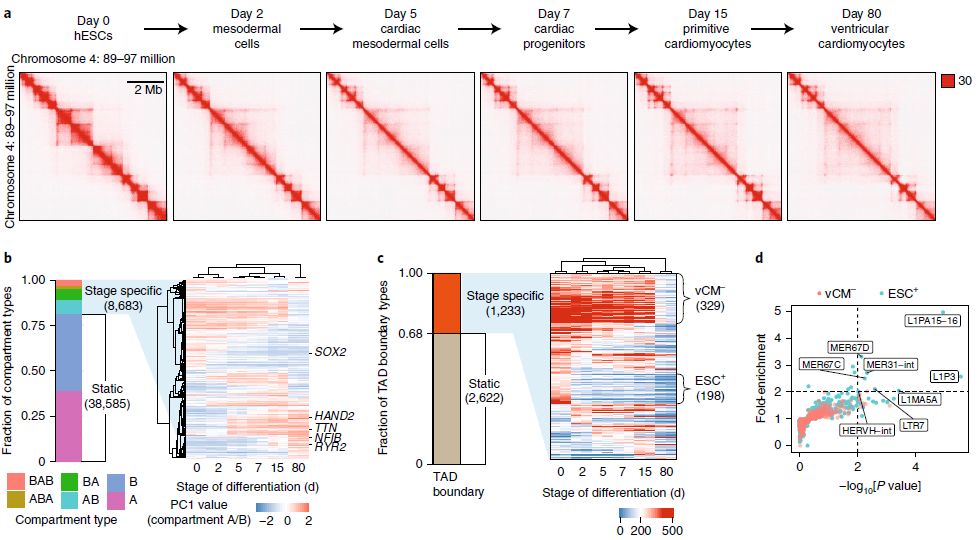
人心肌细胞分化过程中TAD的重组
TAD边界通常在细胞类型和密切相关的物种之间保守,并且可以限制顺式调节元件与靶启动子的相互作用。
在TAD边界处或TAD边界内,经常观察到长程染色质环连接调节元件,包括CCCTC结合因子(CTCF),启动子和增强子的结合位点。
因此,
破坏TAD可导致染色质的适当重组失败以及随后可能最终导致疾病的转录因子的变化。
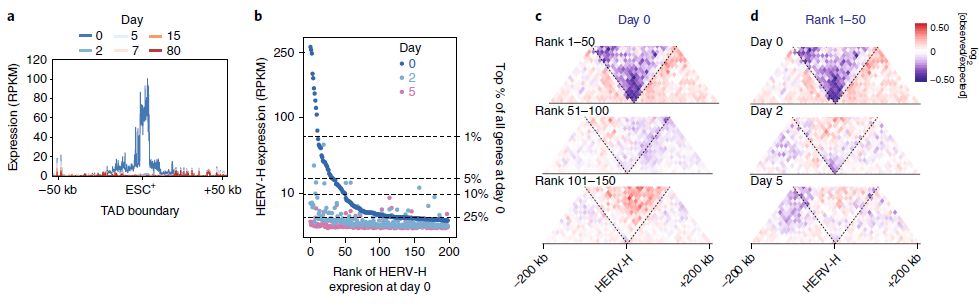
转录活性的HERV-H形成hESC特异性TAD边界
有越来越多的证据表明,大部分TAD由CTCF形成,CTCF占据TAD边界的大部分,并且通常与CTCF共定位的cohesin复合物形成。
已经提出CTCF结合位点的进化和转换是不同物种中基因组结构的进化的基础,因为物种特异性CTCF结合序列的子集被转座因子快速分散 - 特别是短的散在元件。
然而,
在进化过程中,转座因子在塑造基因组结构中发挥了多少作用不是很清楚,特别是在灵长类动物中。
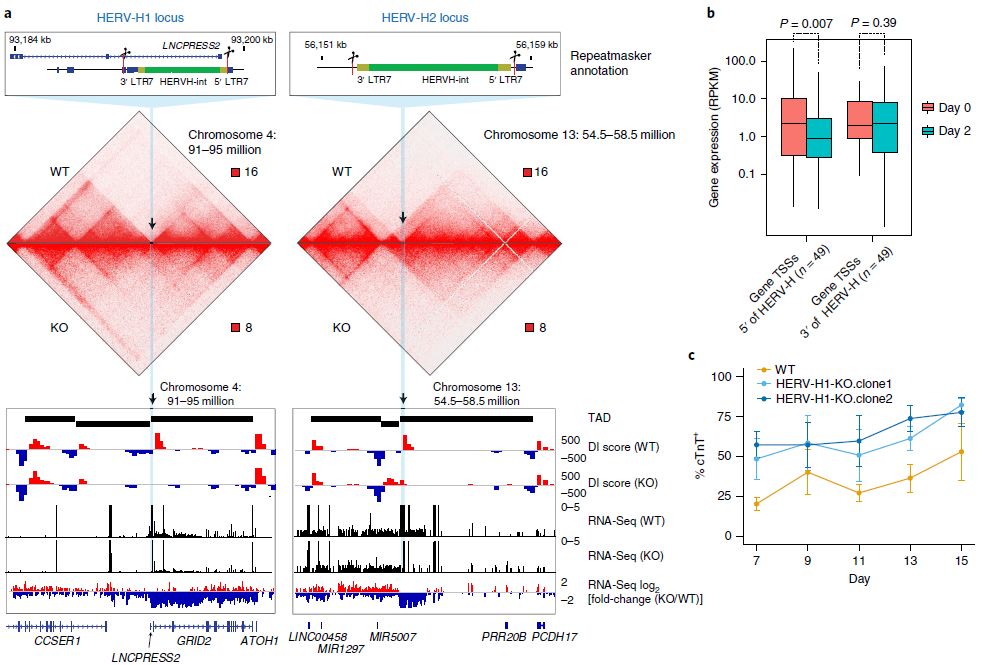
删除两个HERV-H序列导致hESC中TAD的合并
基因组结构不仅在进化过程中被重塑,而且在分化和体细胞重编程过程中以细胞类型特异性方式重新配置。
通过观察人类心肌细胞分化过程中染色质结构的动态重塑,研究人员发现了一类灵长类动物特异性内源性逆转录转座子 - 人内源性逆转录病毒亚家族H(HERV-H) - 参与人类多能干细胞(hPSCs)中TAD边界的建立。
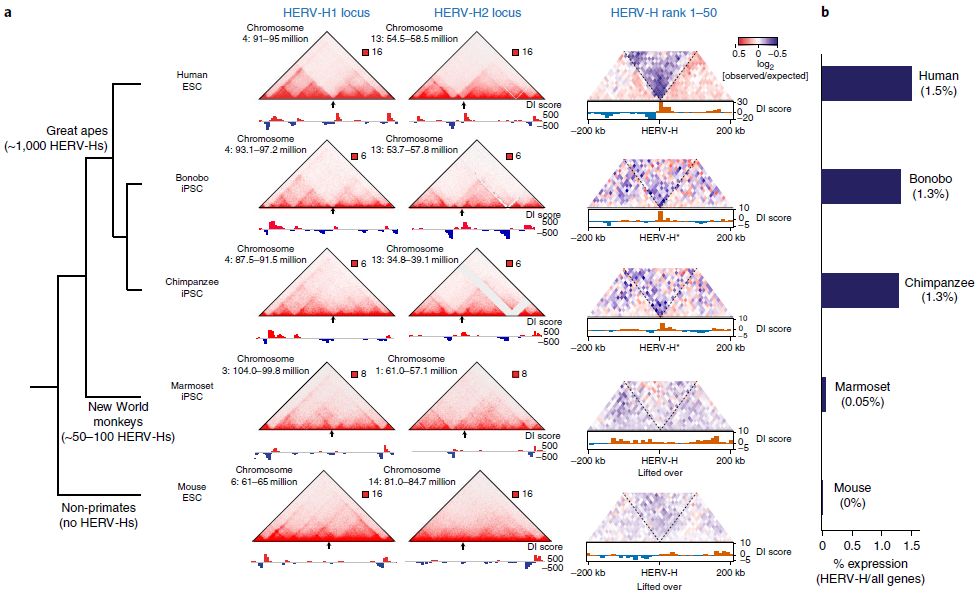
HERV-H在灵长类动物进化过程中引入了新的TAD边界
删除这些HERV-H元件消除了相应的TAD边界,而HERV-H元件的从头插入可在hPSC中引入新的染色质结构域边界。
这些TAD边界还高度依赖于HERV-H转录,因为在hPSC分化期间或通过遗传操作的HERV-H元件的转录沉默削弱或消除了TAD边界。
总的来说,
该研究结果为逆转录转座子元素在进化过程中积极塑造特定细胞类型的染色质结构提供了直接证据。
参考信息:
https://www.nature.com/articles/s41588-019-0479-7
23Plus欢迎表观遗传领域的同行们投稿,分享学术成果、学术见解和学术故事。














