BioArt按
:
SIRT5是Sirtuins中的一员, 与家族其他成员不同,它具有极低的去乙酰化酶活性,却可以调控三种新的赖氨酸修饰——琥珀酰化、丙二酰化和戊二酰化,其中以去琥珀酰化最具代表性,也相对有较多的研究。科学家们在既往的研究中利用质谱技术鉴定了成百上千个SIRT5的潜在底物,而对其生理和病理功能却知之甚少。
6月13日,复旦大学生物医学研究院
杨芃原
、
余红秀
研究组在
Cell Reports
杂志上发表了题为“SIRT5 desuccinylates and activates pyruvate kinase M2 to block macrophage IL-1β production and to prevent DSS-induced colitis in mice”的研究论文,
揭示了SIRT5不仅能够调控巨噬细胞代谢,而且还可能通过调控巨噬细胞代谢在结肠炎甚至结肠炎癌恶性转化中有重要功能。
复旦大学生物医学研究院
王芳
博士为该论文的第一作者,
杨芃原
教授和
余红秀
副研究员为共同通讯作者。

论文解读:
Sirtuin是一类高度保守、
NAD
+
依赖的去乙酰化
酶家族蛋白,具有去乙酰化酶活性。细菌和古菌中含有1-2个Sirtuin,而哺乳动物中一共有7个成员(SIRT1-7),不同的成员有着独特的亚细胞定位。其中SIRT1和SIRT2在胞质和细胞核中都有定位,SIRT6和SIRT7主要定位于细胞核中,其余的SIRT3/4/5则主要定位于线粒体中(
下图
)【1】。
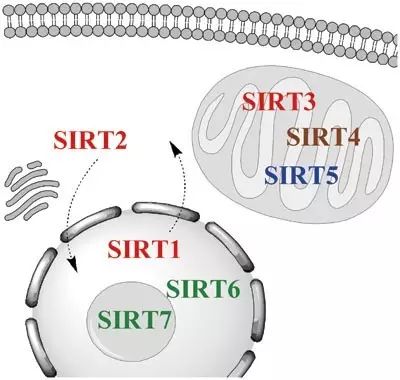
SIRT家族蛋白的亚细胞定位示意图。引自:Herskovits, A. Z., & Guarente, L. (2013). Sirtuin deacetylases in neurodegenerative diseases of aging.
Cell research
, 23(6), 746-758.
Sirtuin
可以通过对多种
底物进行去乙酰化作用,从而在机体内参与维持基因组稳定、维持细胞抗胁迫能力以及参与能量代谢,并且在线虫和果蝇中被认为参与了寿命延长的调节过程【2】。
SIRT5是Sirtuins中的一员, 与家族其他成员不同,它具有极低的去乙酰化酶活性,却可以调控三种新的赖氨酸修饰——琥珀酰化、丙二酰化和戊二酰化,其中以去琥珀酰化最具代表性,也相对有较多的研究【3-6】。
然而科学家们在既往的研究中利用质谱技术鉴定了成百上千个SIRT5的潜在底物【7】,且SIRT5基因敲除的小鼠没有明显的表型【8】,因而而对其生理和病理功能知之甚少。
免疫代谢(immunemetabolism)研究免疫细胞在增殖、分化、应答及转归等过程中代谢调控机制及功能,是国际上前沿和快速增长的研究领域,该领域的发展不仅能从理论上深化人们对免疫细胞生物学的理解,同时也展示了在维持机体免疫稳态、肿瘤免疫治疗等方面的重要的应用前景。
巨噬细胞在被LPS激活后会大量消耗葡萄糖,糖酵解作用显著增强,表达M1型分子标志物并大量产生炎性因子IL-1β,其机制是糖代谢中间产物琥珀酸(Succinate)累积,琥珀酸稳定的Hif-1α加强了IL-1β的转录,糖酵解关键酶PKM2的激活在其中也有重要作用。在此基础上,
杨芃原
和
余红秀
团队进一步发现了PKM2的上游调控机制——
PKM2被SIRT5去琥珀酰化调控
。在SIRT5缺失的细胞中,PKM2的琥珀酰化水平增加,PKM2由四聚体转化为二聚体,同时其丙酮酸激酶活性下降,二聚体化的PKM2进入细胞核,与Hif-1α协同作用结合在IL-1β的启动子区,显著增强了IL-1β的转录,并增强了巨噬细胞的糖酵解作用(
下图
)。
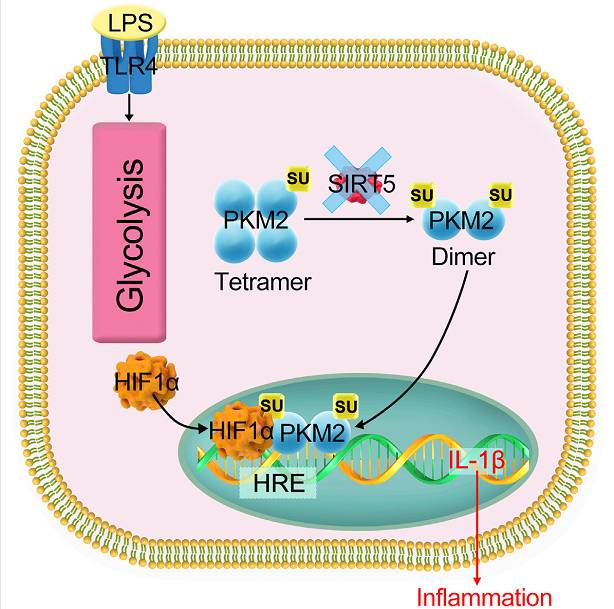
工作模型示意图
因为IL-1β在炎症中发挥重要作用,他们以结肠炎为模型,研究了葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎模型中SIRT5的功能,发现Sirt5敲除小鼠结肠炎明显加重。
这些结果提示SIRT5不仅调控巨噬细胞代谢,还可能通过调控巨噬细胞代谢在结肠炎甚至结肠炎癌恶性转化中有重要功能。
值得一提的是
,这是继他们与复旦大学
赵世民
教授团队合作,发现“SIRT5通过对IDH1和SDH的去琥珀酰化,激活它们的活性,降低了线粒体的琥珀酰化,挽救了线粒体功能,抑制神经胶质瘤细胞代谢和生长”(
Molecular cell
, 2015,60:1-15
)【9】以及与复旦大学
叶丹
教授团队合作,发现“SIRT5通过去琥珀酰化调控IDH2、去戊二酰化调控葡萄糖-6-磷酸脱氢酶(G6PD)的活性增强神经细胞的抗氧化能力”(
EMBO reports
, 2016,17:811-822
)后【10】,发现了SIRT5调控的一个新底物PKM2,阐明了SIRT5调控免疫代谢在炎症中的重要功能。
参考文献:
1、Hirschey, M. D. (2011). Old enzymes, new tricks: sirtuins are NAD+-dependent de-acylases.
Cell metabolism
, 14(6), 718-719.
2、Qiu, X., Brown, K. V., Moran, Y., & Chen, D. (2010). Sirtuin regulation in calorie restriction.
Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics
, 1804(8), 1576-1583.
3
、
Park, J., Chen, Y., Tishkoff, D.X., Peng, C., Tan, M., Dai, L., Xie, Z., Zhang, Y., Zwaans, B.M., Skinner, M.E. et al.
SIRT5-mediated lysine desuccinylation impacts diverse metabolic pathways.
Mol. Cell.
2013; 50: 919–930
4、
Rardin, M.J., He, W., Nishida, Y., Newman, J.C., Carrico, C., Danielson, S.R., Guo, A., Gut, P., Sahu, A.K., Li, B. et al.
SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks.
Cell Metab
. 2013; 18: 920–933
5、
Weinert, B.T., Schölz, C., Wagner, S.A., Iesmantavicius, V., Su, D., Daniel, J.A., and Choudhary, C.
Lysine succinylation is a frequently occurring modification in prokaryotes and eukaryotes and extensively overlaps with acetylation.
Cell Rep
. 2013; 4: 842–851
6、
Identification of lysine succinylation as a new post-translational modification.
Zhang, Z., Tan, M., Xie, Z., Dai, L., Chen, Y., and Zhao, Y.
Nat. Chem. Biol.
2011; 7: 58–63
7、
Tan, M., Peng, C., Anderson, K. A., Chhoy, P., Xie, Z., Dai, L., ... & Ro, J. (2014). Lysine glutarylation is a protein posttranslational modification regulated by SIRT5.
Cell metabolism
, 19(4), 605-617.
8、Yu, J., Sadhukhan, S., Noriega, L. G., Moullan, N., He, B., Weiss, R. S., ... & Auwerx, J. (2013). Metabolic characterization of a Sirt5 deficient mouse model.
Scientific reports,
3, 2806.
9、Li, F., He, X., Ye, D., Lin, Y., Yu, H., Yao, C., ... & Wu, X. (2015). NADP+-IDH mutations promote hypersuccinylation that impairs mitochondria respiration and induces apoptosis resistance.
Molecular Cell
, 60(4), 661-675.
10、Zhou, L., Wang, F., Sun, R., Chen, X., Zhang, M., Xu, Q., ... & Yang, P. (2016). SIRT5 promotes IDH2 desuccinylation and G6PD deglutarylation to enhance cellular antioxidant defense.
EMBO reports
, e201541643.

杨芃原
教授,复旦大学化学系特聘教授,生物医学研究院常务副院长。曾任中国人类蛋白质组学学会理事长,质谱学会常务理事,国家蛋白质重大科学研究计划专家组成员,两次担任国家重点基础研究计划(973计划)首席科学家,除此之外还主持了多项国家自然科学基金委重大重点项目与上海市创新团队项目。曾获教育部自然科学一等奖、二等奖、福建省科技进步一等奖,教育部科技进步二等奖等多个奖项。以通讯作者发表SCI论文两百余篇。主要研究方向为生物质谱仪器开发与应用。

余红秀
博士,副研究员,上海市“浦江人才计划”获得者,复旦大学基础医学院医学系统生物学系副主任,上海市闵行医院兼职教授。研究方向为蛋白质翻译后修饰,肿瘤代谢与免疫代谢。近五年来已在
Cell Reports、Molecular Cell、EMBO reports、Molecular Cellular Proteomics
等国际专业杂志发表论文二十余篇。任
Journal of Proteomics、Proteomics、Scientific Reports
等多种国际刊物通讯审稿人。近五年主持了国家自然科学基金面上项目、青年项目、上海市浦江人才计划、上海市自然科学基金等十二项国家和部级科研项目,作为骨干参与多项国家级重大科学研究计划。获第九届国际蛋白质组学大会 “青年科学家”奖,2016年中国生化大会青年科学家论坛三等奖,2012、2014和2015年复旦大学校级优秀奖。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





