BioArt按
:
RNAi是一种在真核生物中高度保守的转录后基因沉默机制, 并已被公认在真菌、植物和无脊椎动物中起到关键的抗病毒免疫作用。然而在过去相当长一段时间里人们对RNAi是否在哺乳动物中同样起到抗病毒免疫作用仍不清楚。6月20日,中科院武汉病毒所/武汉大学病毒学国家重点实验室
周溪
团队与军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室
秦成峰
团队合作在
Immunity
杂志上发表了题为“Human virus-derived small RNAs can confer antiviral immunity in mammals”的研究论文,
揭示了RNA干扰(RNAi)通路在哺乳动物中具有抗病毒免疫功能,确证了RNAi在哺乳动物中是一条抗病毒天然免疫通路;同时,也揭示了一种人类病毒(既EV71)在逃逸RNAi天然免疫中的具体机制。该工作完善了对哺乳动物抗病毒免疫机制的认识,并为针对该通路的抗病毒药物设计或免疫疗法研究提供了新思路。
鉴于该工作的重要的意义,BioArt特别邀请到了浙江大学生命科学研究院
徐平龙
教授做精彩点评,以飨读者!

论文解读:
RNAi是一种在真核生物中高度保守的转录后基因沉默机制, 并已被公认在真菌、植物和无脊椎动物中起到关键的抗病毒免疫作用。在RNAi抗病毒过程中, 病毒RNA复制所产生的双链RNA(dsRNA)被宿主Dicer蛋白识别并切割成21-23nt小干扰RNA(siRNA)。这些
病毒衍生的siRNAs(vsiRNAs)
被转移到 RNA 诱导沉默复合体RISC上, 并介导同源病毒RNA的降解,从而达到抗病毒的目的【1】(
加州大学河滨分校的
丁守伟
教授在此领域做出了一些列杰出的研究成果,相关研究可参考
【1,2,3,4,5】)。
RNAi在哺乳动物中也保守存在,并被广泛用于生物学研究。但是,过去利用多种病毒进行的研究并未在分化的体细胞和动物水平检测到哺乳动物病毒来源的vsiRNA。而尽管在某些体外实验条件下发现了vsiRNA,也无法证明其具有抗病毒功能。此外,此前的一些研究还表明,在哺乳动物成体细胞中敲除siRNA产生途径中的关键蛋白Dicer或者AGO2并不能增强体内病毒的复制【6,7】。
因此,
对于RNAi是否在哺乳动物中能起到抗病毒作用一直存在较大争议。
在这项研究中,科研人员利用导致婴幼儿手足口病的
人肠道病毒71型
(
EV71
,
引起婴幼儿手足口病的主要病原体之一
)为模型,经过精巧的实验设计及大量反复的实验工作,发现
EV71非结构蛋白3A具有抑制RNAi的功能,能够通过与病毒dsRNA结合来阻止Dicer对其剪切,抑制vsiRNAs的产生
。当3A的RNAi抑制活性被缺失,突变的EV71病毒能在细胞与小鼠中激发强烈的RNAi抗病毒反应,并产生大量vsiRNAs(
下图
)
。这些vsiRNA通过Dicer剪切病毒dsRNA所产生、装配进RISC、并高效介导同源病毒RNA的降解,意味着这些vsiRNA具有抗病毒功能。
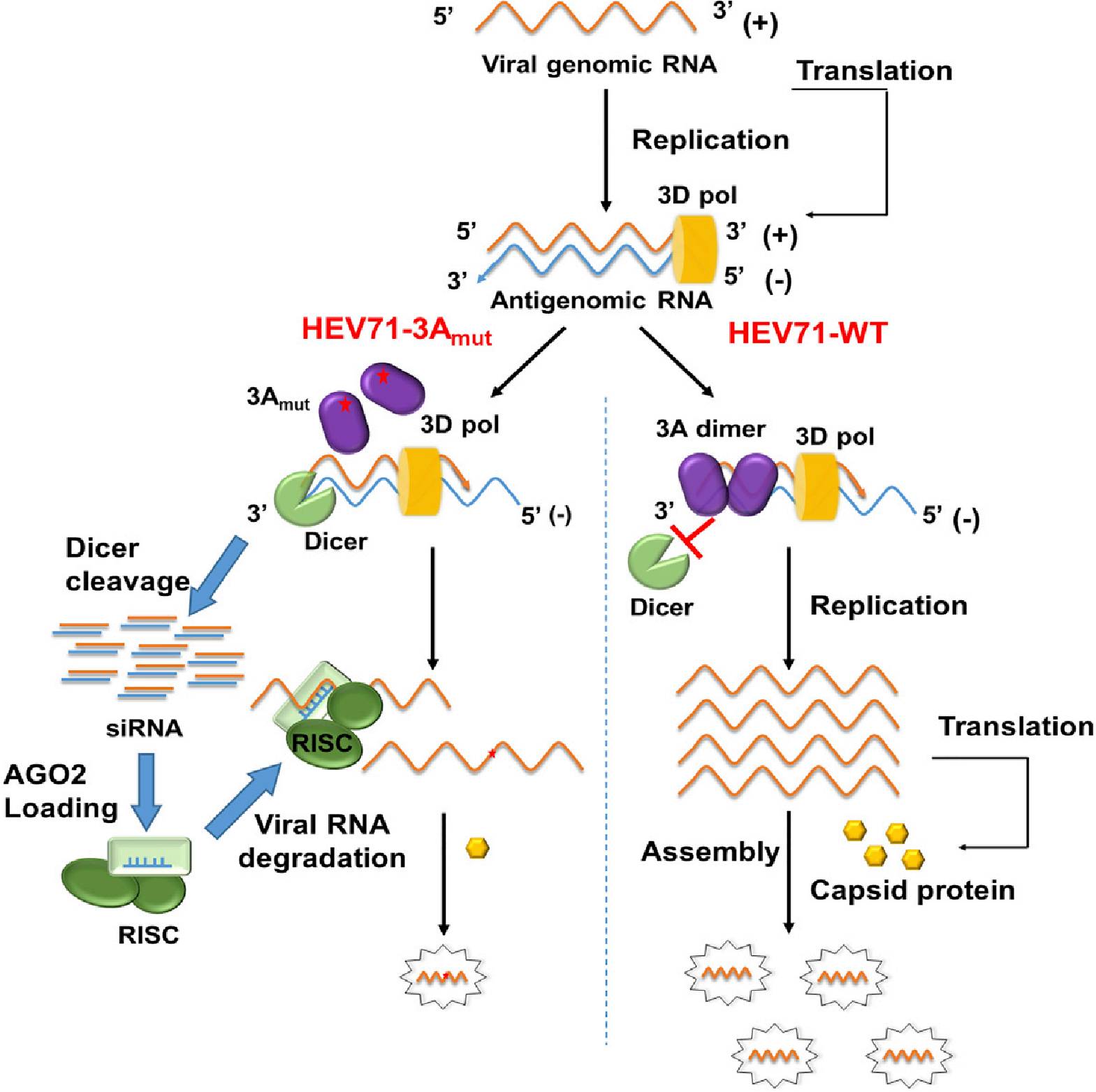
随后进一步的研究表明,在正常的人体细胞和小鼠中,RNAi抑制活性缺陷型EV71病毒的复制被极大的抑制;而通过敲除关键基因使宿主细胞缺失RNAi通路,则能显著的拯救突变病毒的复制及致病性。同时,研究人员还证明RNAi在哺乳动物中所发挥的抗病毒作用不依赖于干扰素反应。
总的来说,上述工作在人类体细胞及动物水平发现了病毒感染可以产生具抗病毒功能的vsiRNA,确证了RNAi在哺乳动物中是一条抗病毒天然免疫通路;同时,也揭示了一种人类病毒(既EV71)在逃逸RNAi天然免疫中的具体机制。该工作完善了对哺乳动物抗病毒免疫机制的认识,为针对该抗病毒通路的后续研究奠定了基础。
据悉,周溪课题组
邱洋
博士,秦成峰课题组博士生
徐炎鹏
,中科院生化细胞所博士生
张尧
为论文并列第一作者,
周溪
教授与
秦成峰
研究员为共同通讯作者。同时参与该研究的还有武汉大学
钟波
教授、中科院生化细胞所
吴利刚
研究员等。本研究得到了国家基金委优秀青年科学基金、英国皇家学会牛顿高级学者基金、中国科学院先导专项、国家973计划、国家863计划青年科学家专题等的支持。
专家点评:
徐平龙
(浙江大学生命科学研究院教授,中组部“青年千人”)

Comments:
RNA干扰(RNAi)机制是植物、节肢动物和线虫类的重要抗病毒防御手段。通过III型RNA酶Dicer剪切病毒RNA生成siRNA,并与Ago蛋白组装成RNA诱导的基因沉默复合体(RISC),该机制降解同源的病毒RNA而抑制病毒复制。作为宿主RNAi机制的反制措施,多种病毒也进化出一类称为RNAi病毒抑制子(VSR)的蛋白分子,用于拮抗Dicer和RISC功能。相反,
脊椎动物则主要利用基于蛋白的干扰素防御系统,RNAi机制在脊椎动物体细胞中的抗病毒免疫功能一直有争议,也缺乏病毒来源的siRNA生成以及其抗病毒作用的实质证据
。
周溪教授最新发表在
Immunity
的研究,以引发婴幼儿手足口病的主要病原体HEV71病毒为对象,鉴定了其非结构蛋白3A是该病毒的VSR。随后利用该VSR缺陷的HEV71,在哺乳动物体细胞和小鼠中发现了高丰度的病毒来源siRNA,并证明该siRNA能够与Ago蛋白组装成有活性RISC复合体,通过介导病毒RNA的降解而抑制HEV71复制。
这项非常有意思的工作不仅首次在哺乳动物体细胞中发现了高丰度的病毒来源siRNA及其抗病毒活性,也揭示了RNAi机制在哺乳动物体细胞和整体动物中的抗病毒功能,因此是哺乳动物RNAi抗病毒功能观念上的重要突破。
工作也深化了我们对HEV71这一重要致病病毒与宿主互作复杂性的认识,也提出了通过调节RNAi或VSR功能进行抗病毒治疗的新思路。
参考文献:
1、
Ding, S. W.
(2010). RNA-based antiviral immunity.
Nature Reviews Immunology,
10(9), 632-644.
2、
Ding, S. W.
, & Voinnet, O. (2007). Antiviral immunity directed by small RNAs.
Cell
, 130(3), 413-426.
3、Wang, X. H., Aliyari, R., Li, W. X., Li, H. W., Kim, K., Carthew, R., ... &
Ding, S. W
. (2006). RNA interference directs innate immunity against viruses in adult Drosophila.
Science
, 312(5772), 452-454.
4、Lu, R., Maduro, M., Li, F., Li, H. W., Broitman-Maduro, G., Li, W. X., &
Ding, S. W
. (2005). Animal virus replication and RNAi-mediated antiviral silencing in Caenorhabditis elegans.
Nature
, 436(7053), 1040-1043.
5、Li, Y., Lu, J., Han, Y., Fan, X., &
Ding, S. W.
(2013). RNA interference functions as an antiviral immunity mechanism in mammals.
Science
, 342(6155), 231-234.
6、Bogerd, H. P., Whisnant, A. W., Kennedy, E. M., Flores, O., & Cullen, B. R. (2014). Derivation and characterization of Dicer-and microRNA-deficient human cells.
RNA
, 20(6), 923-937.
7、Kennedy, E. M., Whisnant, A. W., Kornepati, A. V., Marshall, J. B., Bogerd, H. P., & Cullen, B. R. (2015). Production of functional small interfering RNAs by an amino-terminal deletion mutant of human Dicer.
PNAS
, 112(50), E6945-E6954.

周溪
,博士,现任中科院武汉病毒所研究员,病毒学国家重点实验室副主任,国家“优青”。2001年在武汉大学生命科学学院获学士学位,2008年在德克萨斯大学MD Anderson Cancer Center获博士学位,08-11年在MD Anderson进行博士后研究,2011年回国。先后获得国家优秀青年基金获得者(2015),英国皇家学会“牛顿高级学者”(2017),国家863项目青年科学家(2014),中国微生物学会与法国梅里埃研究院“克里斯托弗-梅里埃青年病毒学奖(一等奖)”(2013),武汉大学“珞珈学者”特聘教授(2014)、湖北省“楚天学者”(2012)等荣誉。曾担任武汉大学生科院病毒学系教授、副主任。主要从事病毒与宿主免疫相互作用机制、病毒核酸的复制及致病机制等研究。回国以来作为通讯作者在
Immunity、Science Advances、PLoS Pathogens、Nucleic Acids Res.、J Virol.、J Biol Chem
等期刊上发表学术论文20篇。

秦成峰
,军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室研究员,病毒室主任。
2001年本科毕业于武汉大学生命科学学院,在军事医学科学院获博士学位,曾获ADVAC Fellowship赴法国交流。主要从事虫媒黄病毒致病机制研究,先后作为通讯获共同通讯作者在
Immunity、Cell Stem Cell、Cell Host Microbe、eLife、PNAS
等杂志发表论文多篇。2016年获英国皇家学会“牛顿高级学者”,2015年获国家优青基金资助,2014年获(原)总后勤部科技新星。曾获爱德华詹纳疫苗学会青年科学家(2016)、中国微生物学会“梅里埃优秀青年科学家奖”、“埃博拉出血热疫情防控先进个人”等。兼任
Scientific Reports、npj Vaccines、BMC Infectious Diseases
等杂志编委。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





