全球实施
UDI
经验下
UDI
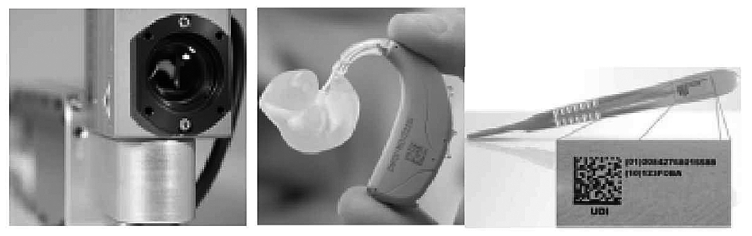
数据载体的
“
标
”
与
“
识
”
姚辰
医疗器械唯一标识
(unique device identifier
,
UDI)
作为医疗器械国际性的通用语言,具有系统性、操作性、开放性的特点,是医疗器械产品的“身份证”,也是实现医疗器械全生命周期精准识别和追溯最有效的方法。医疗器械唯一标识系统
(unique device identification system
,
UDI System)
是当前医疗器械监管领域的热点,
UDI
系统建设更是医疗器械智慧监管的基础。
UDI
是一个崭新且复杂的议题,全面实施涉及企业编码、申报、
UDI
数据载体赋码及验证、数据共享及应用等各环节内容。当前全球
UDI
实施过程中,医疗器械产品
UDI
条码时常无法被读取,导致供应链上
UDI
无法正常使用。因此,
UDI
数据载体在包装或产品上的牢固、清晰、可读对于生产企业是十分重要的环节,是实现医疗器械全生命周期有效实施
UDI
的关键。鉴于此,本研究拟通过概述全球实施
UDI
经验下的
UDI
数据载体 “标”与“识”,探讨
UDI
数据载体赋码及验证正确实施对企业的重要性,以期为各企业能精准有效实施
UDI
提供借鉴。
1 UDI
实施背景
自
2013
年
9
月
24
日,美国食品药品管理局
(FDA)
发布《医疗器械唯一标识系统最终规则》 、制定
UDI
实施战略、推进
UDI
实施以来,很多国家和地区的监管机构相继启动了
UDI
法规的制定工作。目前,欧盟、日本、韩国等均已有
UDI
法规出台。
2019
年
7
月,我国国家药品监督管理局
(
以下简称“国家药监局”
)
会同国家卫生健康委员会
(
以下简称“国家卫健委”
)
联合印发《医疗器械唯一标识系统试点工作方案》,标志着我国
UDI
系统试点工作正式启动;
2019
年
8
月,国家药监局联合国家卫健委成立
UDI
系统试点工作部门协作工作小组,进一步加强
UDI
系统试点工作的组织领导和统筹协调,试点工作稳步推进。
2019
年
8
月,国家药监局发布了《医疗器械唯一标识系统规则》,加强医疗器械全生命周期管理,明确要求注册人
/
备案人应当选择与其创建的
UDI
相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识,确保在医疗器械经营使用期间唯一标识牢固、清晰、可读。
2019
年
10
月
12
日,国家药监局发布了《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》,针对“部分有源植入类、无源植入类等高风险第三类医疗器械”,要求
2020
年
10
月
1
日起开展唯一标识赋码、唯一标识注册系统提交和唯一标识数据库提交等工作。
UDI
是医疗器械产品的“身份证”,包括产品标识
(UDI-DI)
和生产标识
(UDI-PI)
,是
UDI
系统实施中基础且关键的部分。当前全球
UDI
实施过程中,供应链上医疗器械产品
UDI
时常无法读取,因此包装或产品上的
UDI
数据载体的牢固、清晰、可读对于生产企业是十分重要的环节,是实现医疗器械全生命周期有效实施
UDI
的关键。
2 UDI
数据载体的选择
当企业完成发码机构的选择并编码之后,
UDI
数据载体是企业实施
UDI
又一重要的步骤。首先生产企业在选择
UDI
数据载体上需要满足自动识别和数据采集
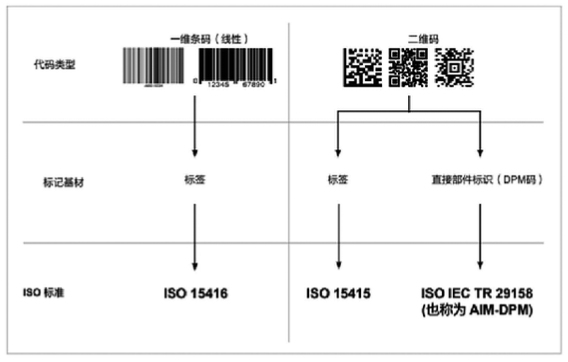
(AIDC)
技术以及人工识读的要求,其中包括一维
(
条
)
码、二维码或射频
(RFID)
标签等形式,见图
1
。
同时发码机构是
UDI
唯一性的重要保证,在
UDI
系统实施中扮演着重要的作用。全球
UDI
实施以来,发码机构的编码标准以及对于数据载体的要求各不相同。以下是全球主要的
2
个发码机构:美国、韩国、欧盟均认可的发码机构全球物品编码组织
(GS1)
和卫生行业商业交流委员会
(HIBCC)
所建立的数据载体标准。
2.1
基于
GS1
标准
一维
(
条
)
码可采用
GS1
标准的
EAN-13
、
GS1-128(
见图
2)
及
ITF-14
码,当
UDI
含有
PI
信息时,应采用
GS1-128
码,技术要求应符合
GS1
标准。


如图
3
所示,
GS1
二维码常采用
GS1 Data Matrix
码,技术要求应符合
GS1
标准。

图
3 GS1 Data Matrix
条码示例
如图4所示,RFID标签采用符合EPC
GEN2协议(ISO/IEC 18000-63)的超高频标签,技术要求应符合Class 1 Generation 2 UHF Air
Interface Protocol Standard 或者ISO/IEC 18000-63的规定。

图
4 GS1 RFID
示例
一维
(
条
)
码可采用
HIBCC
标准的
Code39
、
Code-128
码
(
见图
5)
。目前,
Code-128
码是
UDI
应用实践中较为常用的标准。

图
5 HIBCC Code-128
条码示例
二维码可采用
HIBCC
标准的
Aztec Code
,
Data Matrix(
见图
6)
,
QR Code
码,技术要求应符合
HIBCC
标准,其中
Data Matrix
最为常用。

图
6 HIBCC Data Matrix
条码示例
RFID
标签要求应符合
HIBCC supplier standard for RFID
的规定。企业在确定好发码机构关于标识数据载体标准要求的同时,也要结合流通及医院实际情况,并综合考虑企业的实际管理需求,进而选择适合企业自身的
UDI
标识数据载体。如表
1
所示,本研究结合实际应用经验,综合梳理了一维
(
条
)
码、二维码或
RFID
标签
3
种数据载体形式在实施
UDI
过程中的优劣势。
表
1 3
种
UDI
数据载体在实施
UDI
过程中的优劣势

医疗器械行业产品种类繁多,包装形式各异,选择合适的技术来完成
UDI
数据载体的赋码要求至关重要。从全球实施的经验来看,
2013
年美国
UDI
开始实施时,标签打印机尤为普遍,随着赋码技术的发展,生产效率提高的新型技术也应运而生,热发泡技术、激光机技术、热转印打码检测一体技术也开始进入企业的
UDI
实施。以下是
UDI
实施过程中全球常用的几种技术:
3.1
热转印打码技术
—
针对柔性塑料包装及标签标识
热转印打码技术主要是采用先进的电子式控制方式,精确地控制打印头上的每个微型加热元件,将色带上的墨转印到待标识物上,从而形成字符、图形等,由打印头、打印色带及控制器组成。热转印打码技术的工作原理决定了其应用主要集中在软薄材质,如包装膜、金属箔和标签上等平面的工况线进行作业。在二维码、条形码等信息标识上可显现优良性能。此技术也衍生出打印检测一体技术,见图
7
和图
8
。
对于
UDI
赋码,热转印打码技术具有以下特点:①标识信息分辨率能达到
300/600 DPI
,媲美印刷效果,而且打印质量一致、稳定;②可实现不同类型生产线和便签的赋码;③在线打印标签的同时检测打印效果。

图
7
热转印打印检测一体技术

图
8
热转印技术在软包装及标签上的高质量
UDI
赋码
3.2
热发泡喷码技术
—
针对盒及各种渗透性材料
(
特卫强
)
标识
热发泡喷码技术主要是通过微小加热电阻器加热喷头喷嘴,使墨水产生气泡膨胀后将墨水喷出,从而形成数字、文字、图形,条形码、二维码等。见图
9
。
对于
UDI
赋码,热发泡喷码技术具有以下特点:①适用于在医疗器械的一级或次级包装上进行赋码;②可打印高质量的文字、图案和条形码;③分辨率最高可达
600 DPI
;④喷印信息的高度可以通过多个喷头叠加实现;⑤有多种颜色墨水可供选择。

图
9
热发泡喷码技术在外纸盒及特卫强上进行
UDI
赋码
激光打码技术主要是利用激光发生器生成高能量的连续激光光束,聚焦后的激光作用于承印材料,使表面材料瞬间熔融,甚至气化,或发生颜色变化的化学反应,通过控制激光在材料表面的路径,从而形成需要的图文标记。激光打码可以打出各种文字、条码和图案等,字符大小可以从毫米到微米量级,对产品的防伪有特殊意义。
激光打码的特点是非接触加工,可在任何异型表面标刻,工件不会变形和产生内应力,适于金属、塑料、玻璃、涂层纸盒、陶瓷、木材、皮革等材料的标记。另外,因激光刻划精细,激光打码能形成高质量的永久性标识。见图
10
。
对于
UDI
赋码,激光打码技术具有以下特点:①可标记高精度的文字、一维
(
条
)
码和二维码;②可直接在医疗器械本体上进行标记,也适用于在多级包装上进行标识;③在医疗器械的生命周期内形成永久性标识;④适用于恶劣环境;⑤抵御杀菌过程;⑥可用于标记重复使用的器械;⑦有多种激光源选择,如
CO
2
、光纤、
UV
等;⑧可适用于多种材料,如金属,纸盒,塑料等。
图
10
激光打码技术在本体上的
UDI
打码
UDI
数据载体在厂内能被读取,但在医疗供应链上无法被扫描或扫描的数据不准确等问题,易导致很多产品因为
UDI
无法使用而被退回。造成此问题最主要的原因是生产企业在实施数据载体赋码后只做了赋码后的读码,而非验证。
在整个医疗供应链上,每个数据载体可能遇到各种类型的扫码枪,许多扫码枪配置专门设计的读码算法,能够读取各种变形、棘手和难以读取的数据载体。不同的扫码枪有不同的工作方式,两台扫码枪在处理同一符号时可能会取得完全不同程度的结果。无论是质量控制测试还是扫描仪的流程控制指标,都无法可靠地估计两台不同的扫码枪将如何处理同一数据载体。所以建议生产企业产品在出厂前进行数据载体的验证,以确保数据载体符合发码机构要求的质量要求的同时也确保编码数据的准确。
全球实施
UDI
经验而言,各发码机构对于各自标准的
UDI
数据载体条码质量的要求也基本相同,主要有
3
种质量验证标准
(
见图
11)
。一维
(
条
)
码、二维码的质量需达到
1.5
分
(
国标
)
或者
C
级
(ISO
标准
)
以上:
①包装或者标签上的一维
(
条
)
码:
GB/T 18348/ISO15416
;
②包装或者标签上的二维码:
GBT 23704/ ISO15415
;
③本体上的二维码使用:
ISO/IEC TR 29158
标准
(
也称为
AIM DPM
标准
)
。
如图
12
所示,常规的扫码枪仅用于读取
UDI
载体中的数据,而非验证;企业可以通过在线
CIS
验证技术对条码质量进行检测,同时对编码数据进行验证,确定
UDI
数据载体符合各发码机构对于数据载体质量和数据结构的标准要求,从技术上确保
UDI
数据载体在全生命周期中牢固、清晰、可读。
注:一维
(
条
)
码按照国标
GB/T 18348
,条码的质量等级用数字表示,
4
代表最好,
0
代表最差;二维码按照国标
GB/T 23704
,条码的质量等级用数字表示,
4
代表最好,
0
代表最差
图
11 3
种标准用于确定大多数条码的质量
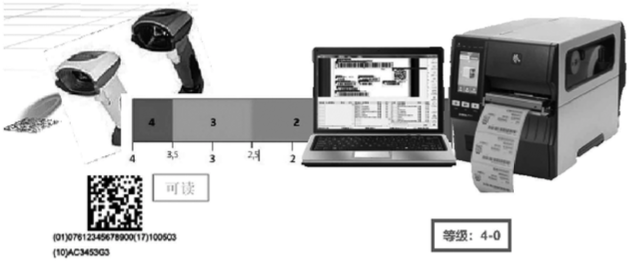
图
12 UDI
数据载体的读取与验证
任何监管框架的变更都会对行业产生一定的影响。然而,挑战的同时也蕴含着诸多机遇,
UDI
法规的实施会给医疗器械行业带来更多的信任,更智能的供应链和更有效的监管。
为了确保
UDI
数据载体的牢固、清晰、可读,有效完成
UDI
在供应链上的种种应用,生产企业需要选择符合市场及自行管理要求的
UDI
标识数据载体,根据数据载体和包装形式选择对应的适宜赋码技术,在出厂前通过数据载体验证的方式确保赋码内容和质量符合行业标准和要求,来最终保证产品的
UDI
在供应链全生命周期过程中正常使用。
参考文献
(
略
)
本文刊登于《中国医药导刊》2020年第10期,更多精彩内容可登陆《中国医药导刊》官方网址:http://www.zgyydy.cn,热忱欢迎智慧监管领域相关研究人员积极投稿。





