提示
:
点击上方
"
行业研究报告
"订阅本号
,以便随时来访。
全球医药外包行业市场规模增长速度稳定。2011 年全球医药外包行业市场规模为 574 亿美元,2015 年全球医药外包行业的市场规模增加到 884 亿美元,2011-2015年复合增速为 11.40%,预计 2016 年市场规模将增加到 989 亿美元。
PS:免费索取报告,请关注“行业研究报告”下方菜单栏“我要报告”项;投资、理财、研修,请关注下方菜单栏“我要投资”项;IPO咨询、BP报告定制,请关注下方菜单栏“我要合作”项。
来源:中泰证券
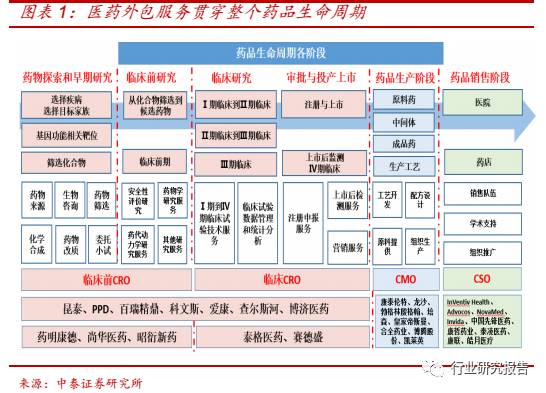
外包服务贯穿整个药品生命周期,国内市场占比逐年攀升
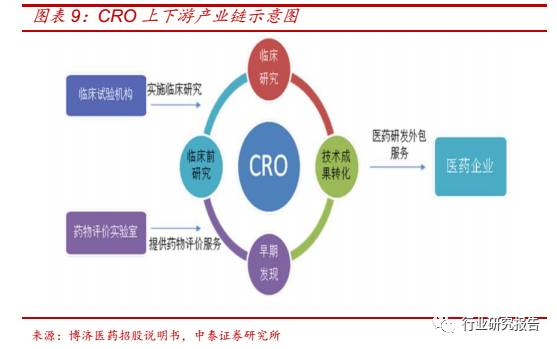
医药外包指制药企业将新药发现及临床前研究、临床阶段新药开发和已
上市药物的商业化生产运营等各环节进行专业化外包,分为 CRO (医药
研发外包)、CMO(医药生产外包)、CSO(医药销售外包)三种:
(1)
CRO 主要为制药企业提供药物发现、临床前研究、临床试验和审批与投
产上市服务等合同研究服务,分为临床前 CRO 和临床 CRO,对创新能
力要求较高,具有人才密集、技术密集的特征。
(2)CMO 主要为制药
企业提供从临床前研究、临床试验到商业化销售阶段的医药中间体、原
料药和制剂的定制研发生产服务,主要分为小分子化学药 CMO 和生物
药 CMO,对产业化能力要求较高,具有人才密集、技术密集、资金密
集的特征,。
3)CSO 主要为制药企业提供品牌塑造、市场推广、病人教
育、公共关系、销售管理等合同营销服务,属于市场营销工作,具有人
才密集的特征。

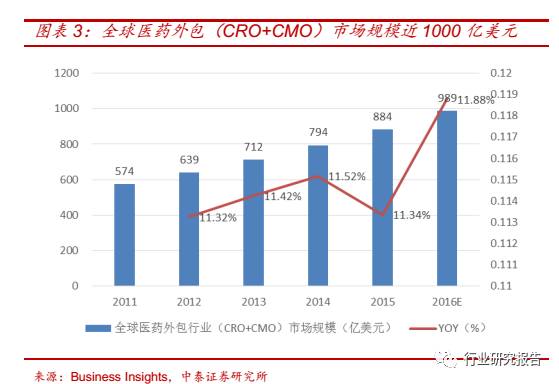
全球医药外包行业(CRO+CMO)市场规模增长速度稳定。2011 年全球
医药外包行业(CRO+CMO)市场规模为 574 亿美元,2015 年全球医
药外包行业(CRO+CMO)的市场规模增加到 884 亿美元,2011-2015
年复合增速为 11.40%,预计 2016 年市场规模将增加到 989 亿美元。
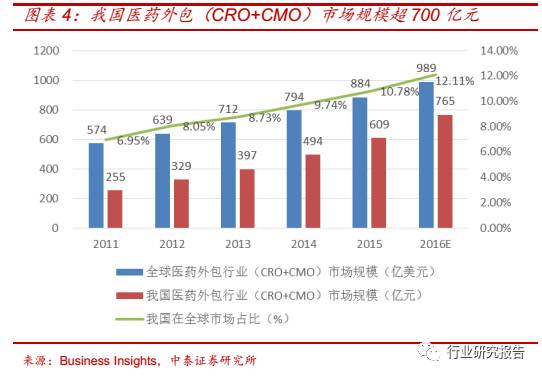
我国医药外包行业(CRO+CMO)市场规模呈快速增长的态势。2011年我国医药外包行业(CRO+CMO)市场规模为 255 亿元,占全球医药
外包行业(CRO+CMO)市场 6.95%的份额,2015 年我国医药外包行
(CRO+CMO)市场规模增加到 609 亿元,占全球医药外包行业
(CRO+CMO)市场份额上升至 10.78%,2011-2015 年复合增速为
24.31%,预计到 2016 年我国医药外包行业(CRO+CMO)市场规模增
加到 765 亿元。
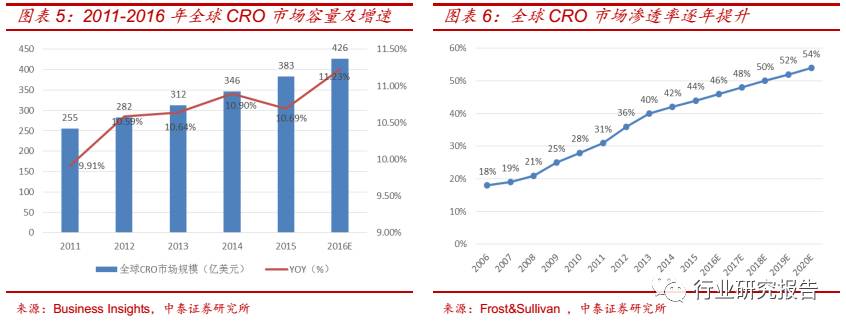
医药 CRO─药政改革加速市场扩容,关注三大核心因素
全球CRO行业市场规模不断扩大,从2011年的255亿美元扩大到2015
年的 383 亿美元, 2011-2015 年复合增速为 10.70%,预计到 2016 年全
球 CRO 行业的市场规模将达到 426 亿美元。全球 CRO 市场渗透率从
2006 年的 18%上升至 2015 年的 44%。在新药开发难度逐渐加大的情
况下,预计到 2020 年,CRO 市场渗透率将进一步提升到 54%。
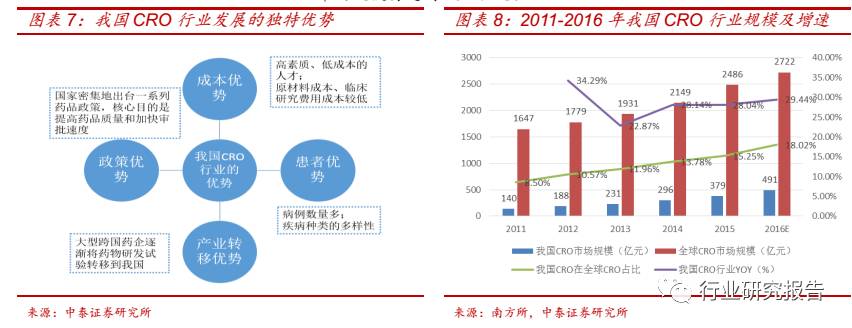
受益于成本、患者、产业转移、政策等独特优势,我国 CRO 行业进入
快速发展阶段。 2011 年我国 CRO 行业市场规模为 140 亿元,约占全球
CRO 行业市场 8.50%的份额,2015 年我国 CRO 行业市场规模为 379
亿元,占全球 CRO 行业市场份额上升至 15.25%,2011-2015 年我国
CRO 行业市场规模复合增速为 28.27%,预计到 2016 年我国 CRO 行业
市场规模将达到 491 亿元。
医药 CRO 于 20 世纪 70 年代起源于美国, 80 年代末随着法规的日益完
善,在美国、欧洲、日本得到迅速发展,90 年代后期以来逐渐发展成一
个独立的行业,在医药研发产业链中处于核心地位。现阶段,CRO 行业
处于行业成长期,市场增长率很高,需求高速增长,技术渐趋定型,行
业特点、行业竞争状况及用户特点比较明朗,行业进入壁垒提高,产品
品种及竞争者数量增多。
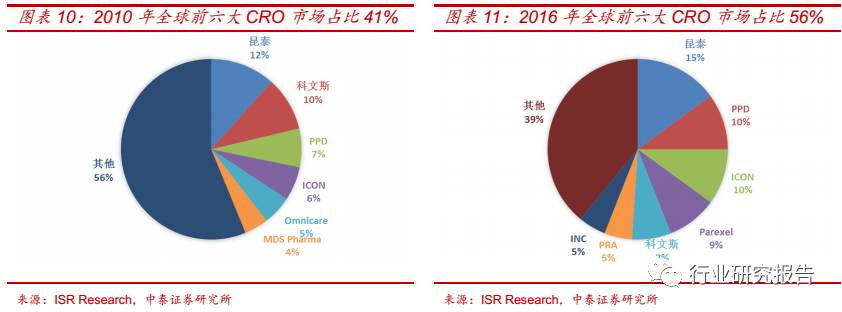
从全球 CRO 行业的竞争格局来看,全球 CRO 行业的集中度不断提升,
其中欧美地区的 CRO 企业在市场上占据约 90%的份额,其中美国占
60%,欧洲占 30%。 2010 年全球前六大 CRO 企业昆泰、科文斯、 PPD、
ICON、Omincare、MDS Pharma 分别占据约 12%、10%、7%、6%、
5%、4%的市场份额,共占据全球 41%的市场份额。2016 年全球前六
大 CRO 企业昆泰、 PPD、 ICON、 Parexel、科文斯、 PRA 分别占据 15%、
10%、10%、9%、7%、5%的市场份额,共占据全球 56%的市场份额。
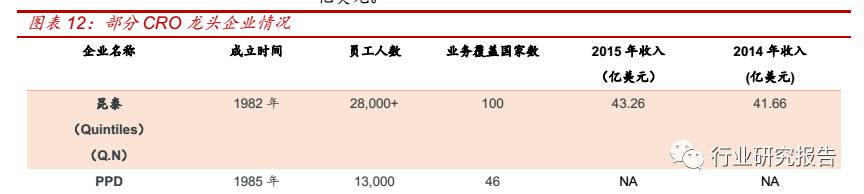
国际 CRO 巨头均能为制药企业提供全产业链的研发服务,在收入规模、
业务覆盖范围、员工人数等方面优势明显。如全球最大的 CRO 企业昆
泰成立于 1982 年,是全球最大的 CRO 企业,拥有 28200 位员工,业
务遍及 100 多个国家,2014-2015 年的营业收入分别为 41.66、43.25
亿美元。

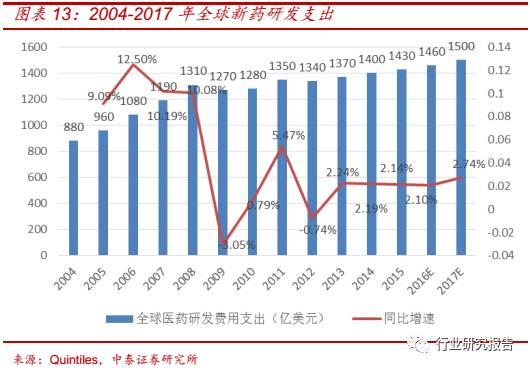
新药研发的复苏拉动 CRO 行业的发展,全球新药研发市场已从 2009 年
世界经济危机造成的研发投入低谷中走出,虽然欧债危机及其后续影响
在一定程度上减缓了全球新药研发市场的复苏,但预计未来一段时间内
新药研发市场将保持 2%左右的增速温和上涨。2010 年全球新药研发支
出为 1280 亿美元,2015 年全球新药研发支出为 1430 亿美元,同比增
速 为 1.86%,预计到 2017 年全球新药研发支出将达到 1500 亿美元。
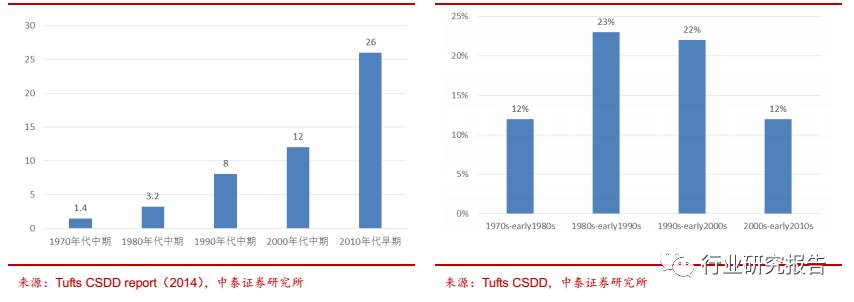
制药企业面临新药研发成本和风险飙升的压力,基于加快研发进度和风
险控制的角度考虑,倾向于将新药研发外包给 CRO 企业。据 2014 年塔
夫茨(Tufts)CSDD 报告显示,每研发一个新药的平均成本已由 70 年
代的不足 2 亿美元飙升至 2010 年的 26 亿美元。但是新药研发的成功率
却持续走低,平均 5000 到 10000 个先导化合物中只有 1 个能最终获得
监管部门的批准,成功率从 80 年代的 23%下降到现在的 12%左右。
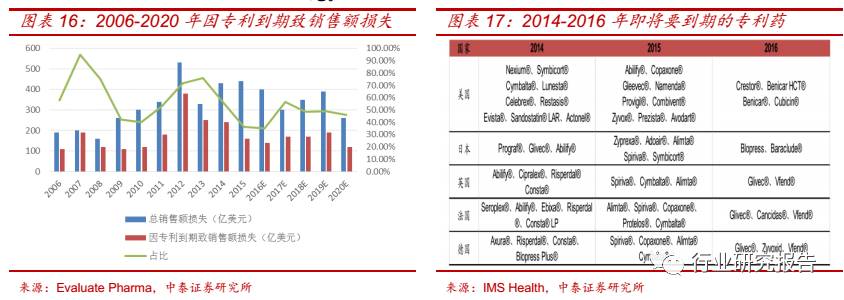
制药企业重量级药品专利到期往往面临大量仿制药上市,致使原研药市
场遭遇专利悬崖威胁,过去依靠专利保护取得的销售收入和利润将大幅
度下跌。一种新药品种从早期研究到进入市场有可能需要经过 10-15 年
的时间,而世界主要国家的新药保护专利期约为 20 年,上市后新药专
利实际有效保护期基本仅剩 5-10 年。因此,通过提高研发效率和缩短研
发周期,争取新药早日上市以享受更长的专利保护期成为制药企业增强
竞争力的重要手段。在全球排名前 20 的制药企业中,有 35%的专利在
2009-2013 年间到期,因专利到期而导致的药物销售额的损失为 1040
亿美元,其中 2012 年因专利到期损失的销售额占总销售额的 7%。预计
2015-2020 年间,因专利到期而造成的药物销售额的损失为 1190亿美
元。
在新药研发成本飙升以及专利悬崖驱动下,CRO 行业得以迅速发展,
CRO 具有突出的优势。①提供一站式综合服务,提高研发效率。CRO
在全球可以涵盖医药研发的整个阶段,提供一个综合化的一站式服务,
以更好地为制药企业服务,提高研发的效率。②专注医药研发,降低研
发成本。 CRO 可以在短时间内迅速组织起高度专业化和具有丰富经验的
临床研究队伍进行新药的研发,从而降低研发成本,缩短研发周期。
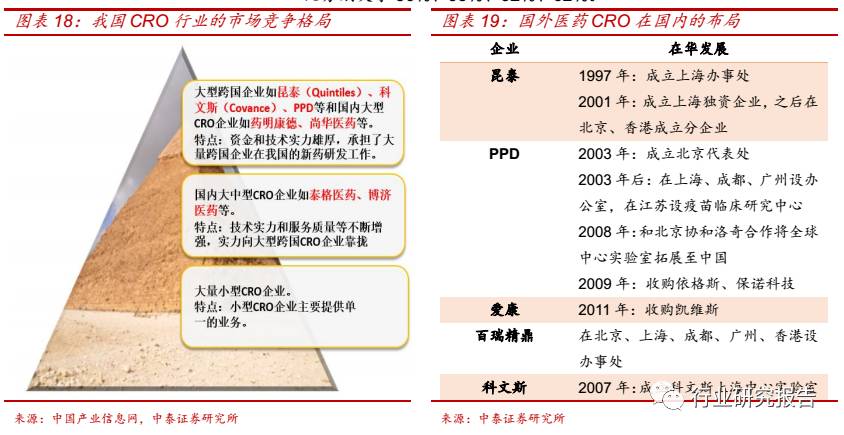
我国的 CRO 行业的发展历史近 20 年,竞争格局可以划分为三个层次:
①大型跨国企业(昆泰(Quintiles)、科文斯(Covance)、PPD 等)
和国内大型 CRO 企业(药明康德、尚华医药等)。大型跨国 CRO 企业
和国内大型 CRO 企业承担了大量跨国企业在我国的新药研发工作,处
于国内 CRO 行业金字塔的顶尖位置;
②国内大中型 CRO 企业(泰格医
药、博济医药等)。实以泰格医药为代表的本土大中型 CRO 公司,技术
实力和服务质量等不断增强,实力向大型跨国 CRO 企业靠拢;
③大量
提供单一业务的小型 CRO 企业。由于我国创新药的发展处于起步阶段,
目前大型跨国企业和国内大中型 CRO 的业务大都以国外客户为主,比
如在国内,昆泰、PPD、药明康德、泰格医药来自于国外客户的业务占
比分别大于 50%、95%、62%、62%。
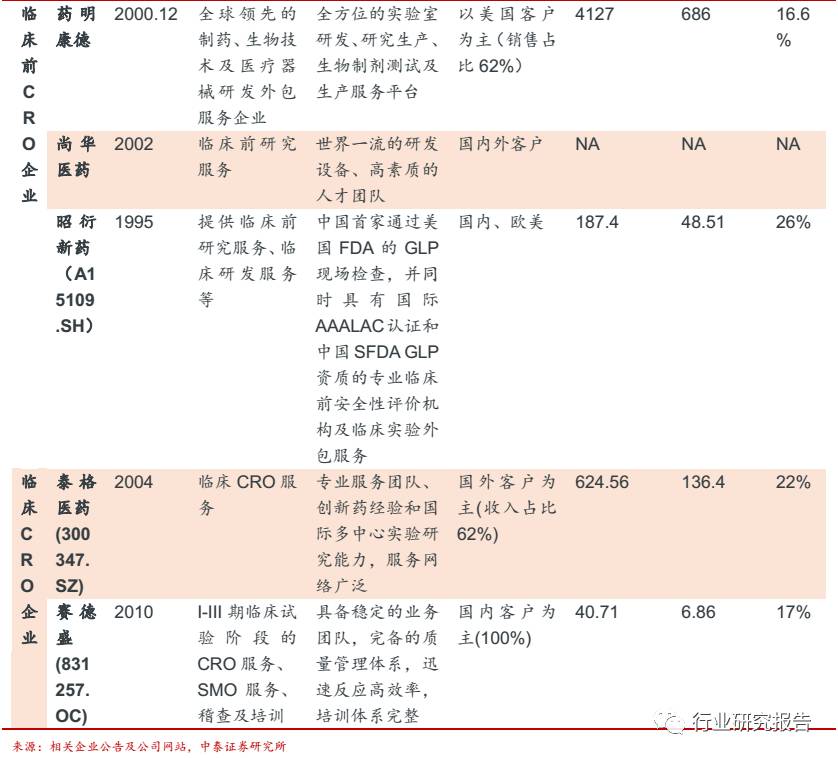
国内 CRO 代表企业主要有博济医药(30404.SZ)、药名康德、尚华医药、
昭衍新药(A15109.SH)、泰格医药(300347.SZ)、赛德盛(831257.OC)。
这些代表企业按照所承担的业务可以分为三类:
①从事一站式综合服务
的 CRO 博济医药(30404.SZ)。
②从事临床前研究(化合物研究服务
和临床前研究服务)的 CRO,包括药明康德、尚华医药、昭衍新药
(A15109.SH)。
③从事临床试验(临床试验的技术服务、数据管理服
务、统计分析服务、注册申请服务等)的 CRO,包括泰格医药
(300347.SZ)、赛德盛(831257.OC)。

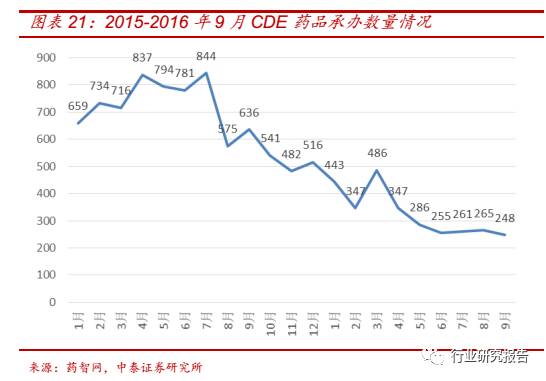
2015 年 7 月 CFDA 发布《关于开展药物临床试验数据自查核查工作的
公告(2015 年第 117 号)》(“ 117 号文”),此文件聚焦在国内医药研
发领域此前常见的临床试验数据不规范、不完整,乃至造假等问题,附
件共列出 1622 个受理号需要进行自查。此次临床数据自查执行力度史
上最严,惩罚力度史上最强。我们认为未来临床数据核查将进入常规化
状态。从短期来看,CRO 企业的订单量将显著减少,订单成本将显著提
升,不合行业规范的中小型 CRO 将面临倒闭的危机,有利于 CRO 企业
的优胜劣汰。从长期来看,临床试验的真实性规范性要求或成为常态,
CRO 集中度也将进一步提高。
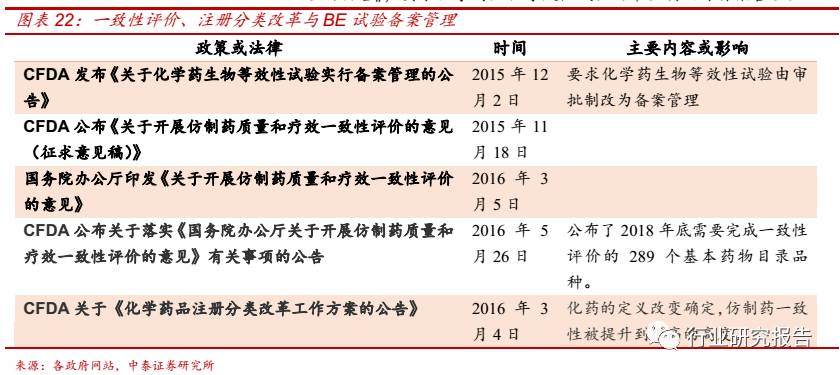
2012 年 1 月,国务院十二五规划首次提出一致性评价,2016 年 5 月 26
日,CFDA 公布关于落实《国务院办公厅关于开展仿制药质量和疗效一
致性评价的意见》有关事项的公告,标志着一致性评价开始进入落实阶
段,规定 2018 年底前须完成仿制药一致性评价的品种包括 289 个,涉
及 19797 个文号,相关企业超 2000 家。2016 年 3 月,CFDA 发布《化
学药品注册分类改革工作方案的公告》,仿制药一致性评价被提升到非常
高的高度。
2015 年 12 月 2 日, CFD 发布《关于化学药生物等效性试验实行备案管
理的公告》,要求化学药生物等效性试验由审批制改为备案管理。
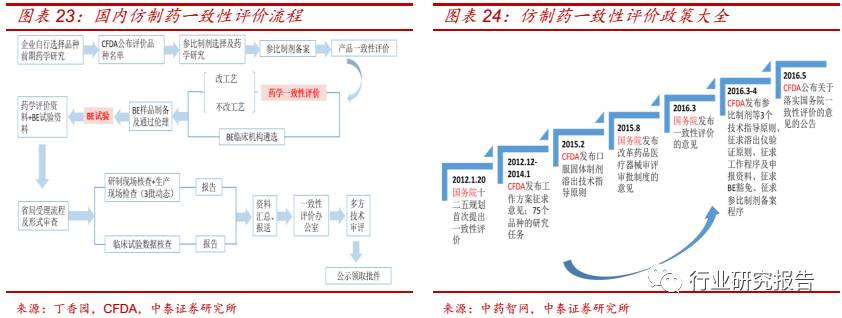
药学一致性评价和 BE 试验仿制药评价的核心试验内容,本次仿制药一
致性评价有望带来 CRO 行业的量价齐升,催生 CRO 行业百亿级市场空
间。BE 试验的价格由 2015 年之前的 30-50 万元左右上涨至 200-250
万元左右,主要原因有两个:
(1)BE 试验供不应求。一方面,由于此
次需完成评价的品种多达 289 个和 BE 试验 BE 试验由审批制改为备案
管理,导致 BE 试验的需求大幅度提升;另外一方面,国内有资质从事
BE 试验的研究机构较少,BE 试验的承接能力有限。
(2)CFDA 监管加
强。
我们按照每个品种有 15 个文号进行一致性评价测算(大于 15 个文号的
品种按照 15 个文号进行一致性评价,不足 15 个文号的品种按照真实数
据进行一致性评价),此次共涉及超过 4000 个文号进行一致性评价,假
设进行一致性评价的费用为 400-500 万(药品一致性评价 200-250 万,
临床 BE 试验 200-250 万),则对应的市场空间大致为 160-200 亿。
医药 CRO 行业未来的发展趋势主要分为三个方面:
1)通过横纵向并购
整合,提供全球化的一站式服务;
2)通过创新模式,由原来的制药企业
的辅助者转变为制药企业的战略伙伴,共担风险,共分收益。
3)全球
CRO 企业的分布集中地区逐渐从北美、西欧等国家向新兴市场国家转
移。
从横向来看,在国际多中心临床试验的要求下,临床业务属地化、 业务
网络的全球化已成为 CRO 行业核心竞争力重要构成部分,国际 CRO 巨
头国内大型 CRO 纷纷在全球广泛布局多中心的专业业务网络。如昆泰
在全球布局了 107 个服务点,分布在 57 个国家和地区;PPD 在全球布
局了 84 个科研服务机构,分布在 46 个国家和地区;药明康德在全球布
局了 21 个研发基地,分布在 5 个国家。

纵向来看,国际 CRO 巨头利用自身的资源优势不断通过并购整合等方
式扩展产业链,打造一站式综合服务平台,实现了临床前、临床试验和
上市后服务的全面覆盖,并因此提升了自身的竞争力和盈利能力,如国
际 CRO 巨头昆泰和国内大型临床前 CRO 企业药明康德,纷纷通过并购
整个的方式将延伸产业链,2016 年 10 月 10 日,昆泰完成了与全球领
先的为医药健康产业提供专业信息和战略咨询服务的艾美仕市场研究企
业(IMS Health) 合并,昆泰正式更名为“Quintiles IMS”,成为全球
第一的 CRO 超级巨头。我们认为未来国际 CRO 巨头有望继续扩展业务
范围,CMO(合同加工外包)和 CSO(合同销售外包)正在逐步融入
到 CRO 企业服务内容中。
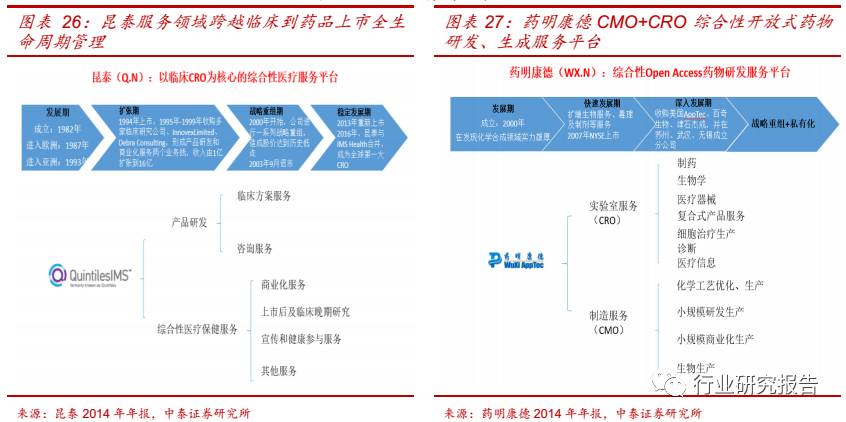
CRO 行业的合作模式逐渐从传统的一次性交易的模式转变为战略同盟
合作关系,实现利益共同分享和风险共同承担。根据 Parexel 企业的调
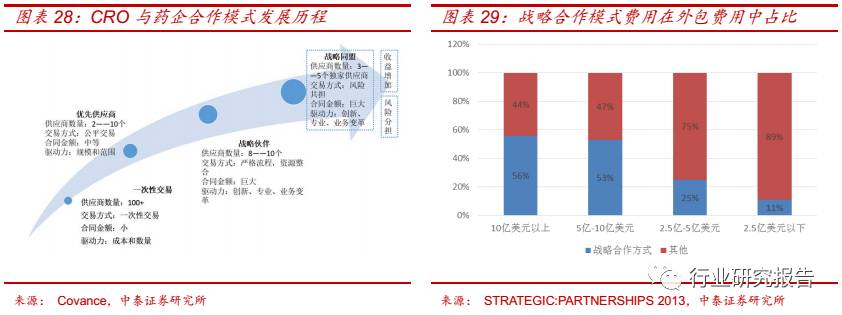
查,目前大多数制药企业都使用战略合作模式,并且研发费用在 5 亿美
元以上的药企都把一半以上的外包费用都用在战略合作模式当中。
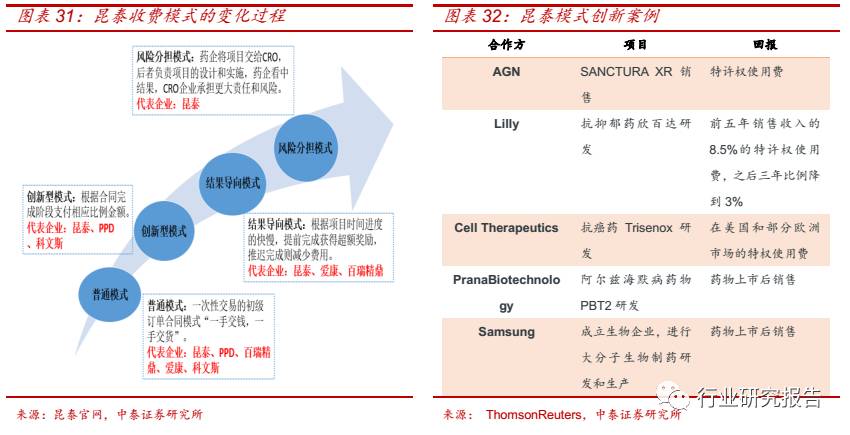
合作模式的变革带来收费模式的创新,统意义上的 CRO,主要是依靠客
户的项目或者向客户提供研发人员来赚取服务费,这种模式类似于“一
手交钱,一手交货”,CRO 获得劳动的收益,但是并不承担研发失败的
风险。在新型的合作模式下, CRO 企业在风险可控的情况下可直接投资
参与药品的研发,并且提供优惠的 CRO 服务,甚至利用自身平台效应
协助销售,然后分享药品上市后的收益。在新型的收费模式下,昆泰近
年来销售收入不断攀升, 2015 年营业收入达到 57.38 亿美元。
近年来,由于亚洲等新兴市场经济高速发展,跨国制药企业投入大量的
资源开展业务,同时新兴市场人力资源成本较低,亚洲地区的 CRO 行
业呈现高速发展的趋势,全球 CRO 企业的分布集中地区逐渐从北美、
西欧等国家向新兴市场国家转移。Business Insights 预计,2011-2016
年,美国和西欧的 CRO 市场规模的年增长率分别为 9.60%和 9.40%,
东欧、中国、印度、亚洲其余国家、拉丁美洲和其他地区的年增长率将
可分别达到 11.40%、28.50%、14.85%、15.60%和 9.80%。中国 CRO
行业的增长速度为 28.50%居全球首位。
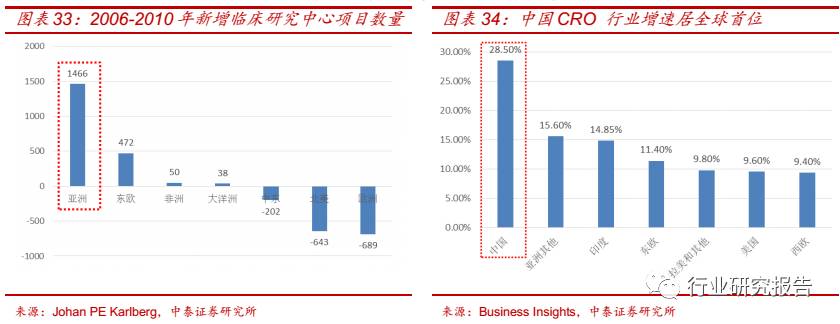
CRO 行业的核心竞争优势主要体现在人才、服务网络、产业链三个方面。
CRO 企业应该不断引进高层次人才,在全球广泛布局服务网络提升市场
份额,并且利用自身的客户资源横纵向扩展产业链提升服务能力、加强
客户粘性,打造成为一站式综合服务平台。
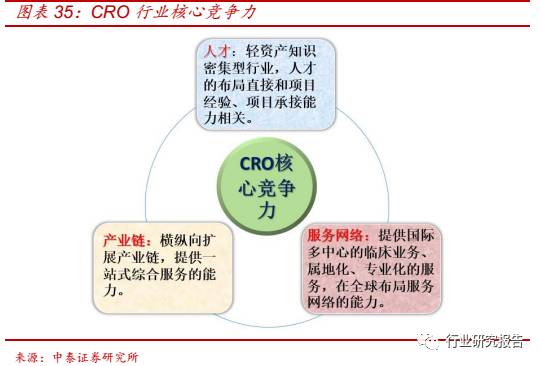
A 股 CRO 企业包括博济医药(300404.SZ)、泰格医药(300347.SZ)
以及拟上市企业昭衍新药。新三板 CRO 企业包括赛德盛(831257.OC)、
立迪生物(838848.OC)等。
博济医药(300404.SZ):
(1)国内少有的提供临床前+临床+技术转化
等一站式服务的企业,客户粘性高;(2)已建成化药口服固体制剂一致
性评价中心和设立生物样本检测子公司,明确受益一致性评价政策; 3)
产业基金已投多家企业,盈利能力将进一步提升;(4)开始承接多项国
际多中心临床实验,开启国际化步伐。泰格医药
(300347.SZ):(1)国
内临床 CRO 行业龙头,是国内为数不多的同时具备制剂开发、药学、
药效评价能力的综合服务平台。(2)子公司上海方达拥有国内领先的生
物样本分析能力,苏州方达具备一致性评价一站式服务能力,为一致性
评价政策最佳受益标的;(3)服务网络覆盖国内 53 个主要城市和亚太
10 多个国家和地区; 4)产业链扩展新模式:通过股权投资基金等方式
参与新药研发,并购整合打造一站式服务体系。
昭衍新药(A15109.SH):
(1)公司拥有高素质的规模化经营的人才队伍;(2)是中国首家通过
美国FDA的GLP现场检查,并同时具有国际AAALAC认证和中国SFDA
GLP 资质的专业临床前安全性评价机构。
赛德盛
(831257.OC):(1)
国内临床 CRO 新秀,业务团队稳定,CRO、 SMO 和稽查与培训等业
务协同发展;(2)重视临床数据标准化建设, WeTrial 平台实现即时、
可视化管理。
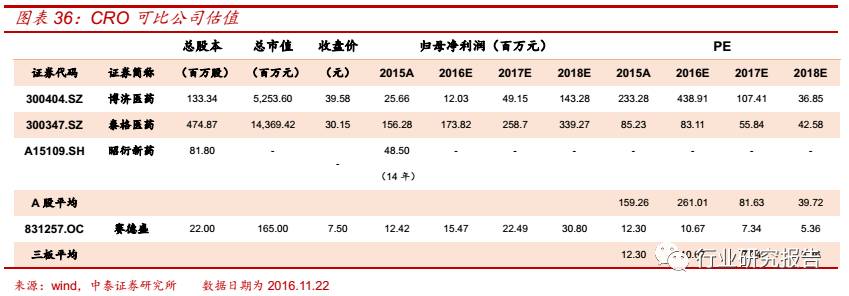
医药 CMO─MAH 制度注入新动力,生物药 CMO 潜力巨大
全球 CMO 市场规模持续扩大,从 2011 年的 319 亿美元扩大到 2015 年
的 501 亿美元,2011-2015 年复合增速为 11.95%,预计到 2016 年全球
CMO 行业的市场规模将达到 563 亿美元。
近年来,受益于人才、成本结构、法律制度、产业转移等优势,我国 CMO
行业得到较快发展。2011 年我国 CMO 行业市场规模为 115 亿元,约占
全球 CMO 行业市场 5.46%的份额, 2015 年我国 CMO 行业市场规模为
230 亿元,约占全球 CMO 行业市场 7.19%,我国 CMO 行业在全球 CRO
行业中市场份额不断提升,2011-2015 年我国 CMO 行业市场规模复合
增速为 18.92%,预计到 2016 年市场规模将达到 275 亿元。
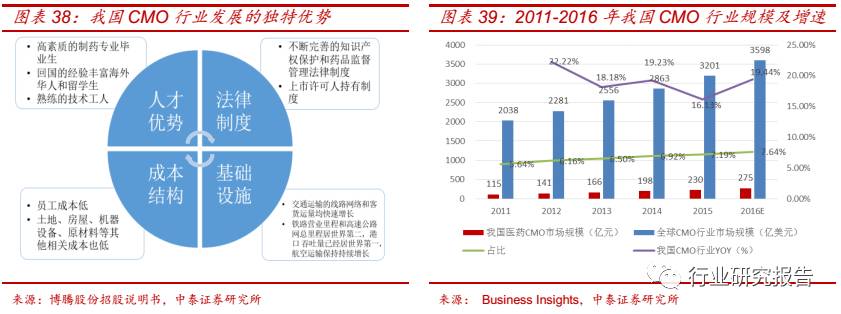
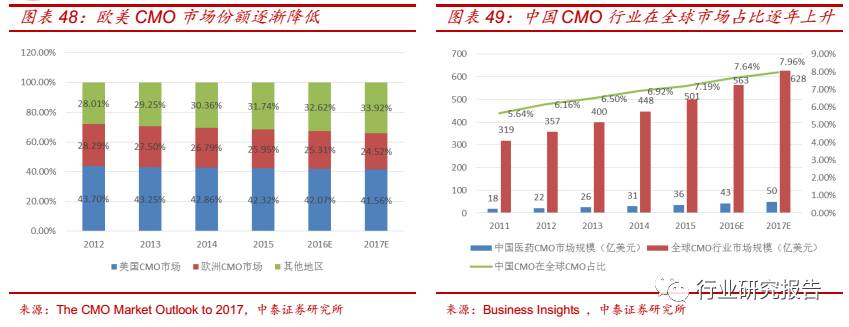
由于欧美拥有高度发达的医药市场和数量众多的大型制药企业,因此欧
美 CMO 企业起步早、技术先进、成熟度高。2015 年,欧美 CMO 企业
占据全球 CMO 行业 68.26%的市场份额,其中,美国占据了 42.12%的
市场份额,欧洲占据了 25.95%的市场份额。
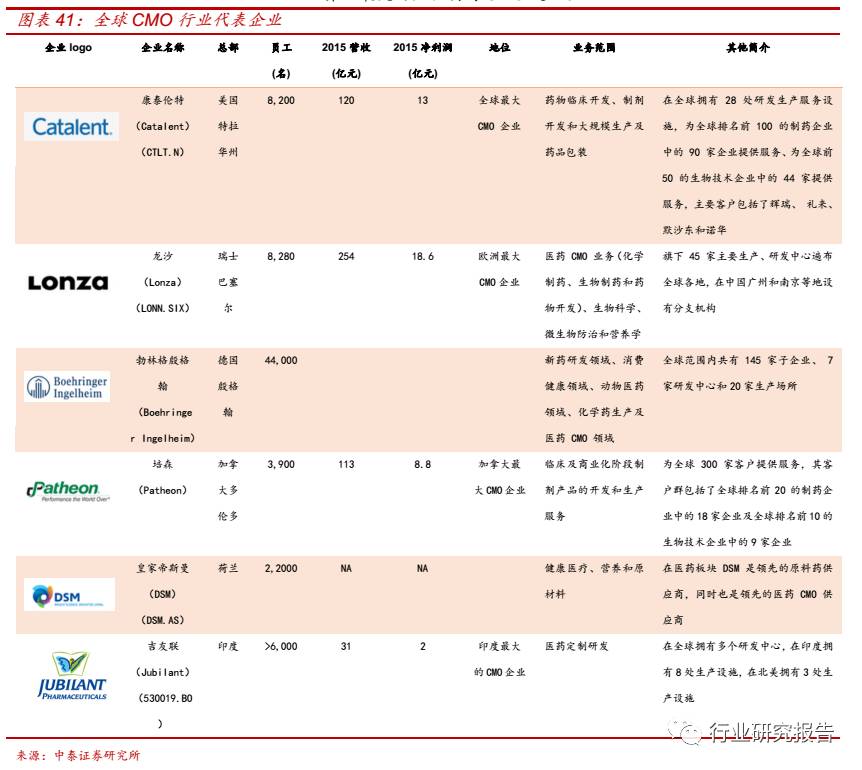
CMO 行业高度市场化,竞争激烈,行业集中度低,CR5 约为 15%。根
据 Business Insights 统计,2011 年全球一共只有 5 家 CMO/CDMO
企业的医药外包服务收入超过 5 亿美元, CR5 约为 15%,其中康泰伦特
(Catalent)占比 5.02%,为最高,龙沙(Lonza)占比 3.76%、勃格
林殷格翰(Boehringer Ingelheim)占比 3.26%、培森(Patheon)占比
1.77%、皇家帝斯曼(DSM)占比 1.63%。国外 CMO 代表企业有康泰
伦特(Catalent)、龙沙(Lonza)、勃林格殷格翰(Boehringer Ingelheim)、
培森(Patheon)、皇家帝斯曼(DSM)、吉友联(Jubilant)等。全球
CMO 巨头基本是由化工行业起家,其中勃林格殷格翰是生物行业起家,
世界上最大的生物制药 CMO 之一。
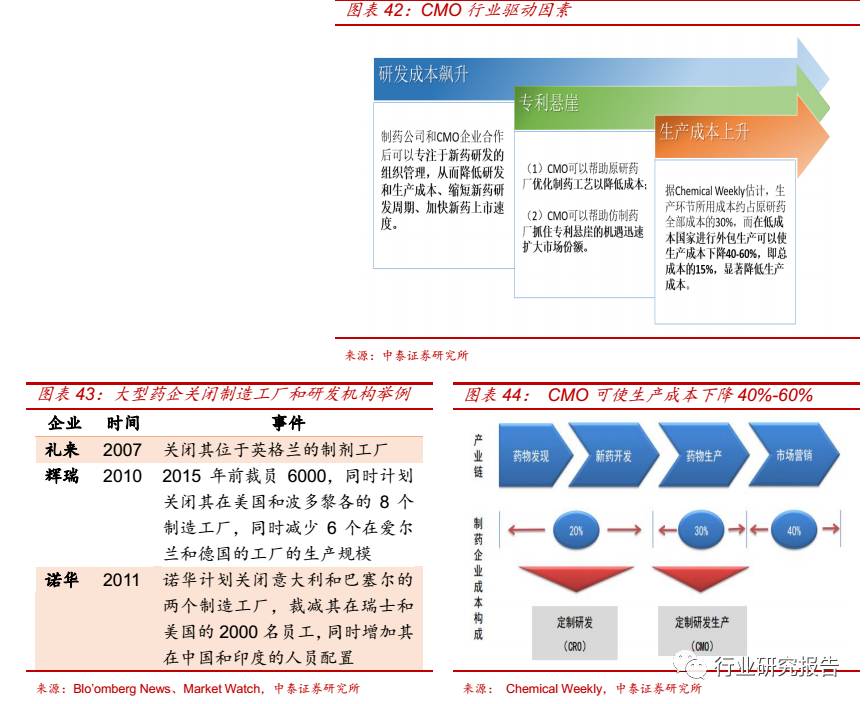
医药 CMO 行业的驱动因素除了研发成本的飙升和专利悬崖外,还包括
制药企业生产成本的上升。随着物价上涨、人力成本升高等,大型制药
企业资本密集型的生产板块如生产设施、生产人员等对制药企业造成越
来越大的压力,致使其大规模裁员、关闭工厂、压缩研发团队规模,医
药 CMO 企业具有生产效率高、成本更可控的独特优势,迎来新的发展
机遇。据 Chemical Weekly 估计,生产环节所用成本约占原研药全部成
本的 30%,而在低成本国家进行外包生产可以使生产成本下降 40-60%,
即总成本的 15%,显著降低生产成本。
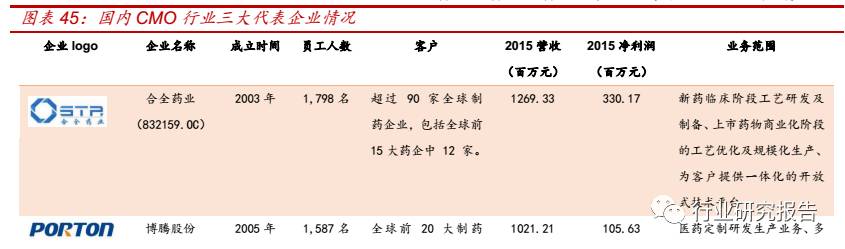
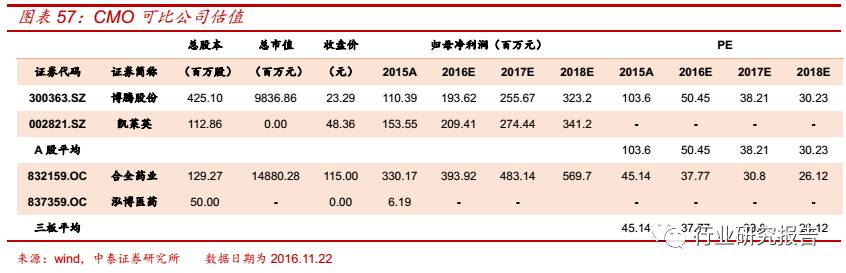
国 内的 CMO 代表 企业 有 合全 药业 (832159.OC )、博 腾股 份
(300363.SZ)、凯莱英(002821.SZ)等。合全药业(832159.OC)为
药明康德的全资子公司,主要服务的药品类型为小分子化学创新药。博
腾股份(300363.SZ)目前主要做小分子化学药医药中间体的定制研发
服务,2015 年公司 70%的收入来自于强生和吉利德,未来将增加原料
药和生物药 CMO 业务。凯莱英(002821.SZ)主要为创新药和重磅药
物提供从临床Ⅰ期、Ⅱ期、Ⅲ期至上市后不同阶段的一站式服务。

卫生部 2011 年 1 月 17 日发布《药品生产质量管理规范(2010 年修订)》
(即新版 GMP)。新版 GMP 与 98 版相比,管理和技术要求上相当严格。
此次新版 GMP 的认证标准提高, CFDA 将 GMP 认证权力下放至省级单
位,总局将采取飞行检查方式核查各环节,另有跟踪检查。飞行检查,
即总局将在不通知被检企业的情况下对其采取快速的现场检查,能够掌
握制药企业实际生产状况,配合重点行业重点企业跟踪检查,起到强力
监督作用。
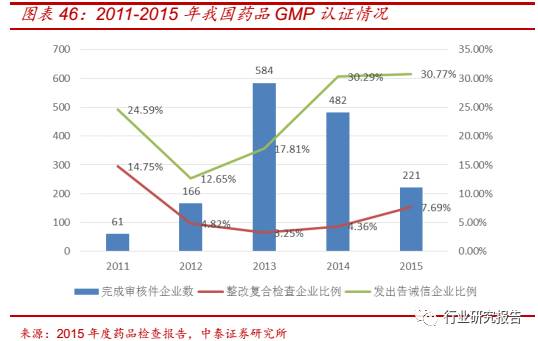
新版 GMP 旨在解决我国医药行业严重的产能过剩问题, CFDA 的《2015
年全国收回药品 GMP 证书情况统计》显示,2015 年全国共有 140 家药
企的 144 张 GMP 证书被收回。新版 GMP“倒逼”我国医药生产模式的
创新,医药 CMO 专注于生产工艺的研发和药品的生产,有助于解决产
能过剩引起的同质化竞争严重、生产经营不规范、低水平重复和无序竞
争等问题,从而得到快速发展的机会。
2016 年 6 月 6 日,国务院印发《药品上市许可持有人制度试点方案》,
从即日起到 2018 年 11 月 4 日, 在北京、天津、河北、上海、江苏、
浙江、福建、山东、广东、四川等 10 个省(市)开展药品上市许可持
有人制度(以下简称 MAH) 试点。试点行政区域内的药品研发机构或
者科研人员可以作为药品注册申请人,提交药物临床试验申请、药品上
市申请,申请人取得药品上市许可及药品批准文号的,可以成为药品上
市许可持有人。
我国传统的药品注册制度是上市许可与生产许可合一的管理模式,仅允
许药品生产企业在取得药品批准文号,经药品生产质量管理规范认证后,
方可生产该药品。药品研发机构的新药研制成功后,如果要自己上市,
则必须投入巨大资金建设生产线,给研发机构造成巨大的压力,还容易
造成分散重复的后果。如果药品研发机构将药品研发成果廉价出售给有
生产资质的大型药企,则容易打压研发机构的积极性,不利于创新,不
利于保证药品的质量,抑制 CMO 需求。
MAH 制度是欧美、日本等制药发达国家和地区的通行做法。在 MAH 制
度下,药品批准许可和药品生产许可分离,减少中间环节,有利于新药
加速上市。药品研发机构科研通过合同生产外包的方式,将生产外包给
专业的 CMO 企业,具有较强药品生产能力的 CMO 企业可以最大限度
利用自身资源打造生产核心竞争力。 MAH 制度催生巨大外包需求, CMO
行业生产设备与资源集中化,高研发能力、专业化、规模化的生产企业
占据主导优势,给 CMO 行业发展注入新的动力。

医药 CMO 未来发展趋势主要体现在三方面: 1) CMO 行业市场供给逐
渐向新兴市场转移。 2)医药 CMO 向医药定制研发生产 CDMO 模式转
变。(3)小分子化学药 CMO 是主流,生物药 CMO 快速发展。
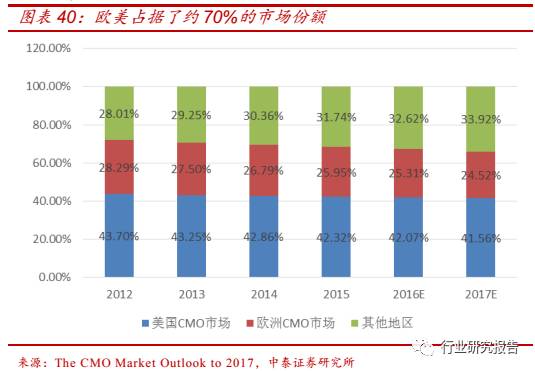
CMO 行业市场供给逐渐向新兴市场转移。虽然 CMO 行业市场需求集中
在欧美,但是成本过高、早期创新工艺发展缓慢等成为欧美 CMO 企业
发展的制约因素,导致增长较缓慢。中国、印度等作为人口众多、经济
高速增长的新兴市场,CMO 企业拥有工艺研发创新灵活、人力成本低、
原材料价格低廉等优势,潜力巨大。2012-2015 年,欧美在全球 CMO
行业的市场份额分别为 71.99%、70.75%、69.64%、68.26%,呈逐年
下降的趋势。新兴国家以中国为例在全球 CMO 行业的市场份额逐年提
升, 2013-2015 年,中国医药 CMO 分别占据全球 6.50%、 6.92%、 7.19%
的市场份额,预计到 2017 年,国内医药 CMO 将占据 7.96%的市场份
额。
着创新药研发成本提升、专利权大量到期、药品监管趋严等,制药业寻求降低研发及生产成本、提高经营效益的有效方法,医药 CMO 由
医药定制生产逐渐升级为医药定制研发生产(CDMO),医药 CMO 企业
的技术能力逐渐成为药企关注的关键因素,医药 CMO 企业与药企建立
合作关系的基础逐渐着眼于质量和价值等方面。
医药定制生产的典型业务模式为“技术转移+定制生产”,仅根据药企提
供的生产工艺等技术方案直接进行定制生产,不需要进行实质性的研发
工作,是制药企业满足生产能力不足的策略性选择,市场需求不连续,
具有零星交易的特点,医药定制生产企业对药企依赖性较强,且关系不
稳定。
医药定制研发生产(CDMO)的典型业务模式为“定制研发+定制生产”,
主要在制药企业尚未掌握生产工艺或者生产工艺不适合工业化生产等情
况下,根据制药企业提供的化学结构进行生产工艺研究开发、质量研究、
安全性研究等定制研发工作,并在定制研发的基础之上进行定制生产,
在 CDMO 模式下,CDMO 企业与药企实现了在研发、采购、生产等整
个供应链的深度合作,能够建立相互支持和相互依赖的长期战略合作伙
伴关系。

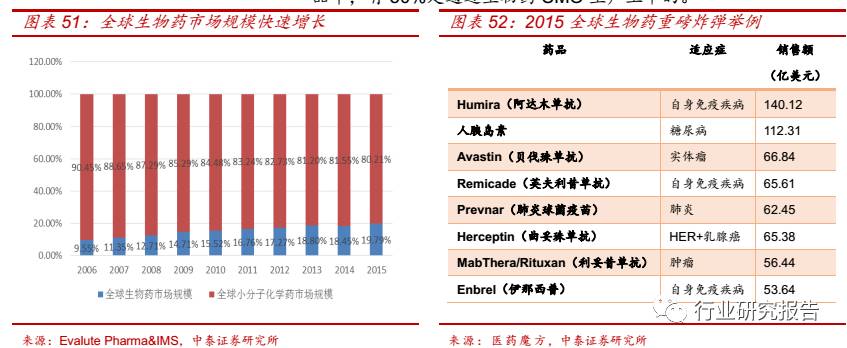
小分子化学药 CMO 是主流,生物药 CMO 快速发展。在全球医药市
场中,小分子化学药市场份额一直保持 80.00%以上,小分子化学药
CMO 是主流。但是由于生物药具有突出的疗效和社会效益,且生物
药多为销售额超十亿美元的“重磅炸弹”,能为制药企业带来丰厚的
利润,作为一个方兴未艾的朝阳产业,近年来生物药发展较快,在全
球医药市场的份额从 2006 年的 9.55%增加到了 2015 年的 19.79%。
生物药和生物类似药市场规模的不断扩大提升了生物药 CMO 的需
求。生物药 CMO 可以将原本生物制药产业链中的“生产瓶颈”变成
“服务平台”,专注商业化生产工艺和质量控制的开发,从而帮助生
物药研发企业的在研新药实现产业化,并使其价值最大化。经过近
20 年的发展,国外的生物药 CMO 已非常规范,根据 BioPlan 第 11
份生物制药企业生产力年度调查报告,目前全球已上市的生物制药产
品中,有 50%是通过生物药 CMO 生产上市的。
我国生物药起步比较晚,在全球占据 6.00%左右的市场份额,但是我国
生物药市场发展迅速,占国内医药市场的份额从 2009 年的 13.60%增加
到了 2015 年的 21.54%。
国务院 6 月 6 日开始推行的上市许可持有人制度对于我国生物药 CMO
的发展起到了关键的推动作用。我国传统的上市许可和生产许可合一的
药品注册制度使得我国生物药产业化的发展难以推进,上市许可持有人
制度推行一方面鼓励了生物药研发企业的研发积极性,另外一方面也给
我国生物药 CMO 的发展创造了良好的政策环境。2016 年 2 月 18 日,
位于上海张江的勃林格殷格翰中国生物制药生产基地,被选定成为国内
首个开展生物药 CMO 的试点企业,未来我国生物药 CMO 行业潜力巨
大。
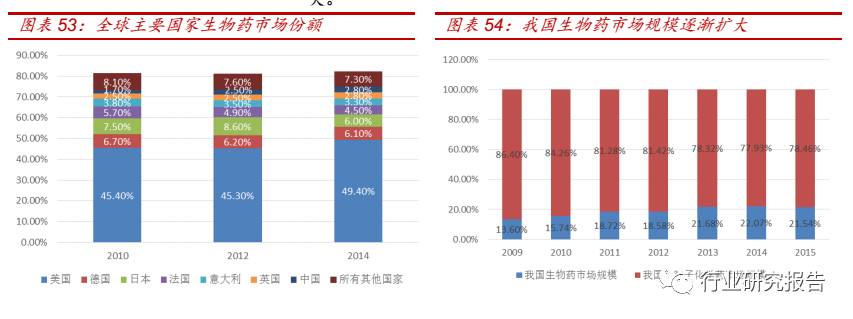
CMO 行业的核心竞争优势主要集中在研发能力、新技术开发及应用、
生产能力(设备、人员、经验)等方面。CMO 企业要想成为高级竞争
者,获取广阔的利润空间,就必须抢占国际制药技术制高点,同时通过
对制药工艺的持续创新与优化,建立高效的绿色经营和可持续发展模式。
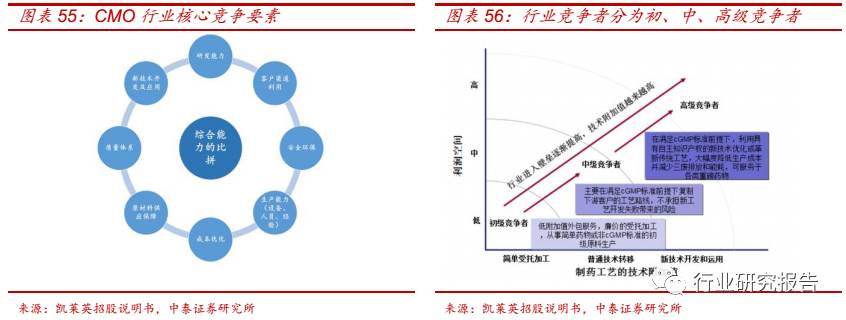
A 股 CMO 企业包括博腾股份(300363.SZ)、凯莱英(002821.SZ),
新三板 CMO 企业包括合全药业(832159.OC)、泓博医药(837359.OC)
等。
博腾股份(300363.SZ):(1)推行“大客户+”战略,在深化与强生和
吉利德的合作关系基础上,持续拓展下游客户; 2)横向往生物药 CMO
扩张,纵向往原料药生产延伸;(3)实施全球化布局,在美国建立研发
中心。
凯莱英(002821.SZ):(1)大客户+大品种,与和核心客户保持
长期稳定合作关系;(2)技术优势和研发实力不断提升;(3)产能不断
扩充。
合全药业(832159.OC)(1)依托母公司药明康德强大的化学药
研发实力,拥有一支由超 800 名化学家组成的研发团队;(2)国内第
一个能够为美国市场生产创新药原料药( API)的 FDA 认证企业,唯
一一个获得多国认证的 CMO 企业;(3)规模领先。
泓博医药
(837359.OC):具有高研发能力和强生产储备。
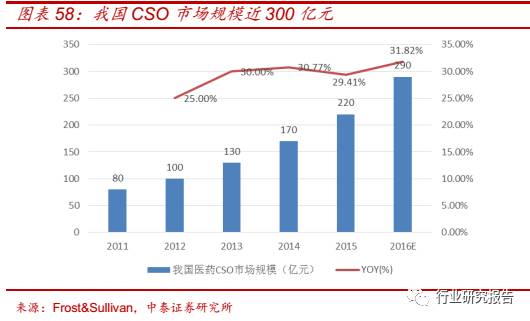
医药 CSO─CSO 行业处于导入期,改革创造新机遇
全球 CSO 行业整体属于导入期,但是随着医药外包服务行业专业化的
发展,销售外包有望成为新发展趋势。我国受益于成本、政策等优势,
CSO 市场规模快速增加。2011 年我国 CSO 行业市场规模为 80 亿元,
2015 年我国 CSO 行业市场规模增加到 220 亿元, 2011-2015 年复合增
速为 28.78%,预计到 2016 年市场规模将达到 290 亿元。
国外药品流通环节简单,药品从药企到医药终端一般只要经过一层经销
商/分销商,药品零售领域是药品销售主渠道,占据了 60%以上的市场份
额。在市场份额高度竞争、药品利润不断被压缩、准入壁垒持续上升、
监管日趋严格等严峻背景下,制药企业面临着成本日益高昂、零售市场
开拓艰难等现实问题,必须寻找新的营销模式,CSO 模式应运而生。
国外 CSO 的服务模式和需求很明朗,在过去 5 年中,欧美医药市场发
生了许多变化,药厂销售队伍从鼎盛时期的 10 多万人陆续裁减至 7 万~
8 万人,并不断增加与 CSO 公司的合作,药企普遍采取自主经营加 CSO
混搭的模式,比如默沙东就采取自主销售新产品,医药 CSO 销售成熟
产品的策略,在裁减 1200 名销售人员后,与 InVentiv Health 签约,帮
助销售科素亚(Cozaar)和海捷亚(Hyzaa)。
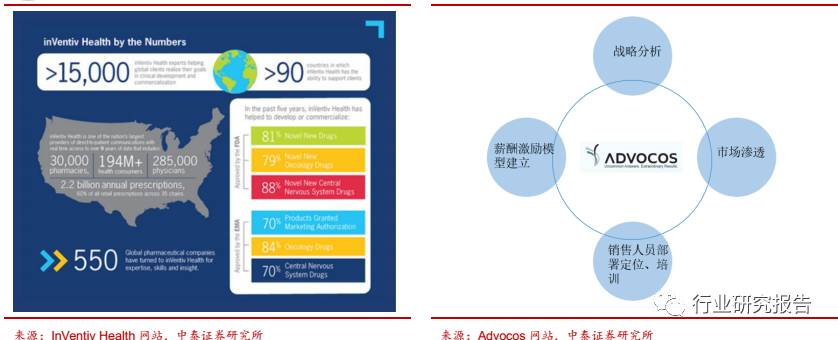
国外的 CSO 企业如美国的 InVentiv Health 成立于 1999 年,公司拥有
员工超过 15,000 人,在全球 90 多个国家布局,是一家为生物制药公司
同时提供差异化的 CRO 与 CSO 服务以帮助药企提高经营绩效的公司。
荷兰的 Advocos 公司是一家提供独特营销解决方案的 CSO,主要服务
领域为制药、生物技术和医疗设备工业。
目前,只有少数的国外 CSO 进入国内市场主要包括 NovaMed (诺凡麦)
和 Invida(英维达)。诺凡麦成立于 2006 年,总部设在上海,拥有超过
600 名销售人员,2011 年被美国的赛生药业收购,赛生药业的主打产品
为用于乙肝治疗的 Zadaxin(日达仙),其 90%以上的销售份额在中国,
收购以后赛生药业在中国的销售队伍扩大到 680 人,销售额和利润明显
增加。英维达成立于 2005 年,拥有超过 4000 名员工,在全球 13 个国
家和地区推广超过 70 个品牌的产品,涵盖了基本用药、皮肤护理,日
常消费品,并实现 23%的年复合增长率。

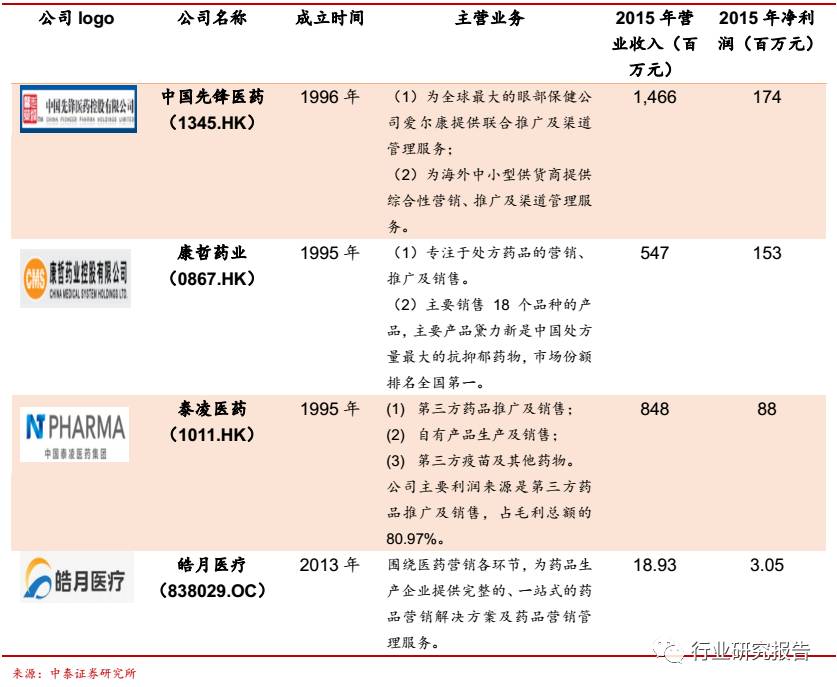
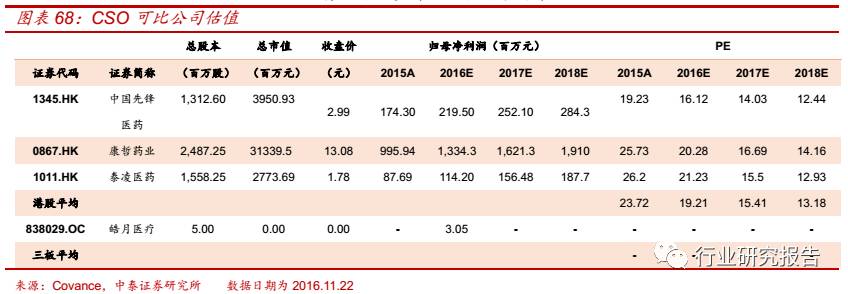
国内的 CSO 代表企业主要有中国先锋医药(1345.HK)、康哲药业
(0867.HK)、泰凌医药(1011.HK)、皓月医疗(838029.OC)。中国先
锋医药(1345.HK)创立于 1996 年,主营业务主要分为两块:(1)为
全球最大的眼部保健公司爱尔康提供联合推广及渠道管理服务;(2)为
海外中小型供货商提供综合性营销、推广及渠道管理服务。康哲药业
(0867.HK)成立于 1995 年,是一家面向医院全部科室的医药服务公
司,专注于处方药品的营销、推广及销售。泰凌医药(1011.HK)于 1995
年创立,目前公司已经从一家老牌疫苗和药品分销商成功转型成为以推
广自主新药和第三方(复旦张江)创新药为主业的综合型医药集团。皓月
医疗(838029.OC)成立于 2013 年,公司的主营业务围绕医药营销各
环节,为药品生产企业提供完整的、一站式的药品营销解决方案及药品
营销管理服务。
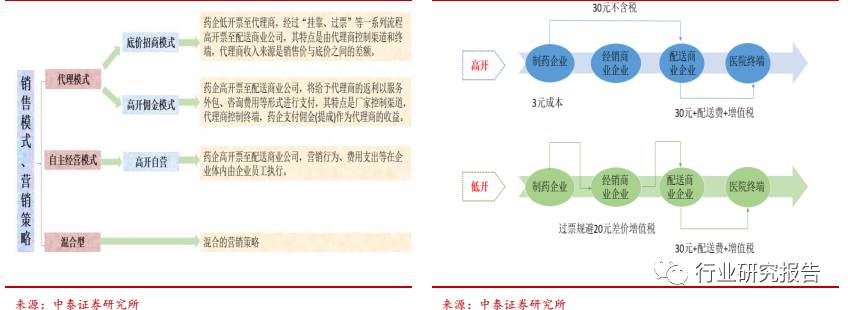
我国药企传统的销售模式主要分为自主经营模式、代理模式、及前两者
的混合型三种。自营模式下的营销策略为“高开”,代理模式下的营销策
略包括“高开”(高开佣金制)和“低开”(底价招商模式)两种。近 10
年来,我国 80%以上的药企都采取底价招商模式,即药企以底价先款后
货方式与代理商合作,其特点是由代理商控制渠道和终端,代理商收入
来源是销售价与底价之间的差额这种模式导致我国医药流通环节复杂、
流通链条长,药品从药企要经过多层代理商、批发商销售才能到到医药
终端,在流通过程中需要通过外部的过票公司来完成整个资金、费用的
循环,这种模式存在并维持的必要条件是高药价、无序的商业流通和粗
放的价格管理。
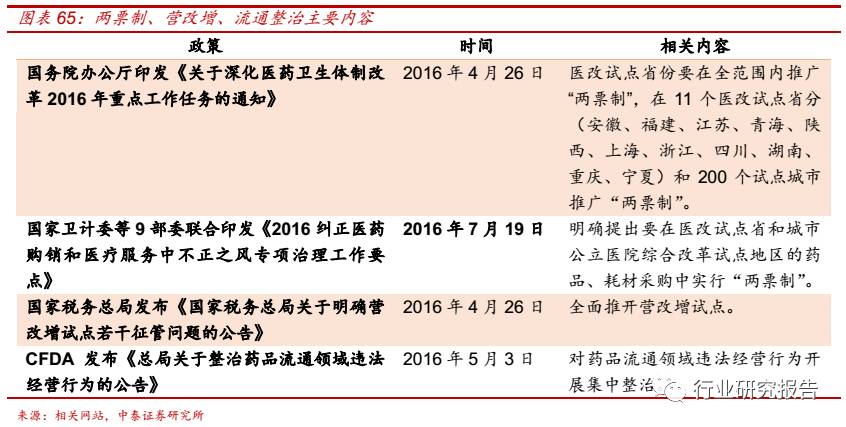
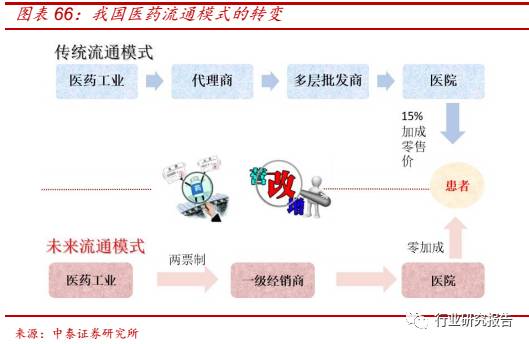
2016年4月26日,国务院办公厅印发《关于深化医药卫生体制改革2016
年重点工作任务的通知》,医改试点省份要在全范围内推广“两票制”,
“两票制”指药品从药厂卖到一级经销商开一次发票,经销商卖到医院
再开一次发票,并且每个品种的一级经销商不得超过 2 个,医院和药品
生产企业直接结算货款,药企和配送企业计算配送费用。7 月 19 日,国
家卫计委等 9 部委联合印发《2016 纠正医药购销和医疗服务中不正之风
专项治理工作要点》,明确提出要在医改试点省和城市公立医院综合改革
试点地区的药品、耗材采购中实行“两票制”。
2016 年 4 月 26 日,国家税务总局发布《国家税务总局关于明确营改增
试点若干征管问题的公告》,明确自 2016 年 5 月 1 日起,全面推开营改
增试点,将建筑业、房地产业、金融业、生活服务业纳入试点范围。
2016 年 5 月 3 日,国家食品药品监督管理总局发布“2016 年第 94 号
公告”《总局关于整治药品流通领域违法经营行为的公告》,决定对药品
流通领域违法经营行为开展集中整治。
上述流通领域改革措施对传统医药流通产业链造成巨大冲击:
一、过票
商业或将消亡。在“两票制”下,由于药品交易及开票绕开了过票公司,
再加上“营改增”使得无票可过,过票商业或将消亡。
二、药企被迫由
“低开”转为“高开”。“高开”模式下,一方面药企的销售收入陡升,
而“营改增”后,按章纳税需要考虑高开部分 17%的增值税和 25%的企
业所得税,使得药企税收负担加重,另外一方面,药企的财税处理压力
加大,包括代理商返款问题、销售费用冲账问题等。
三、代理商和自然
人转型组建 CSO 公司强化专业营销能力。
四、医药商业集中度提高,
强者恒强。各级商业企业将被上下游收编或者外包,大型商业企业“营
销职能”有望成为业务发展重点,给国内 CSO 快速扩张带来契机。
五、
药企逐步剥离销售体系。药企与销售体系脱离隶属和雇佣关系,转移分
摊风险,共同构建风险-收益分摊机制和风险防火墙。
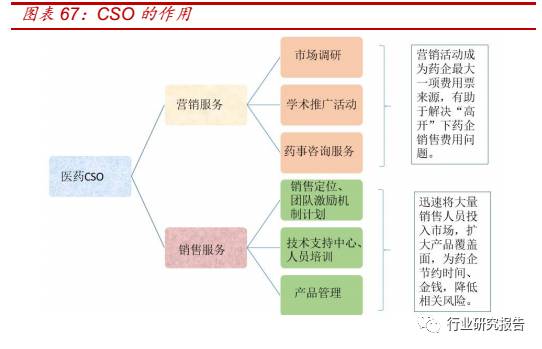
CSO 不同于我国传统的代理模式,主要专注于销售环节的外部服务,一
方面围绕药企的核心竞争力为药企量身打造营销方案,承担药品第三方
营销服务,比如进行市场调研、推广活动(科室会、学术会等)、药事咨
询服务等必须执行的日常营销任务,这些营销活动成为药企最大一项费
用票来源,有助于解决“高开”下药企销售费用问题。另外一方面, CSO
可以提供提供包括产品销售定位、团队激励机制计划、技术支持中心、
人员培训、产品管理等众多销售服务,迅速将大量销售人员投入市场,
扩大产品覆盖面,为药企节约时间、金钱,降低相关风险。
CSO 的核心竞争优势体现在渠道、专业性、产品池、人力、信息化建设
五个方面。优秀的 CSO 公司需要有丰富的营销渠道资源,能提供专业
的营销方案,并且拥有精选的优秀产品池以及对产品的掌控能力,同时
需要有专业的销售团队和先进的信息化平台。
港股 CSO 企业包括中国先锋医药(1345.HK)、康哲药业(0867.HK)、
泰凌医药(1011.HK)。新三板 CSO 企业包括皓月医疗(838029.OC)
等。
中国先锋医药(1345.HK): 1)产品市场化导向下的轻资产模式,经营
风险小、业绩弹性大; 2)丰富的医药营销经验和完善的医药营销网络,
医院覆盖率高。康哲药业(0867.HK): 1)强大的学术推广的网络; 2)
2000 多人的销售代表,销售规模化,很强的执行能力;(3)拥有 ERP
系统。泰凌医药(1011.HK)核心竞争力主要体现在渠道优势、技术优
势及品牌优势。皓月医疗(838029.OC)核心竞争力体现在专业的营销
服务能力、多样化的营销渠道等方面。
——END——
文章非声明均来源于网络,如有侵权请联系我们删除!

如果您这篇文章很“赞”,请
点击一次底部广告
,这也是支持我们运营的一种方式,行研君在此感谢!





