
目前,尽管已有多款PD-1/PD-L1单抗在国内外被批准用于治疗各种实体和血液系统恶性肿瘤。
然而,PD-1/PD-L1治疗的低反应率仍有待解决,
联合疗法
已被作为重要的临床治疗策略。而且一些联合疗法已经验证,包括PD-1/PD-L1联合化疗、放疗、血管生成抑制剂、靶向治疗、其他免疫检查点抑制剂、共刺激分子激动剂、干扰素基因激动剂激动剂、粪便微生物群移植、表观遗传调节剂或代谢调节剂具有卓越的抗肿瘤功效和更高的反应率。此外,含有PD-1/PD-L1部分的双功能或双特异性抗体也具有更有效的抗肿瘤活性。这些联合疗法策略同时促进癌症免疫周期中的多个过程,消除免疫抑制刹车,并协调免疫支持性肿瘤微环境。
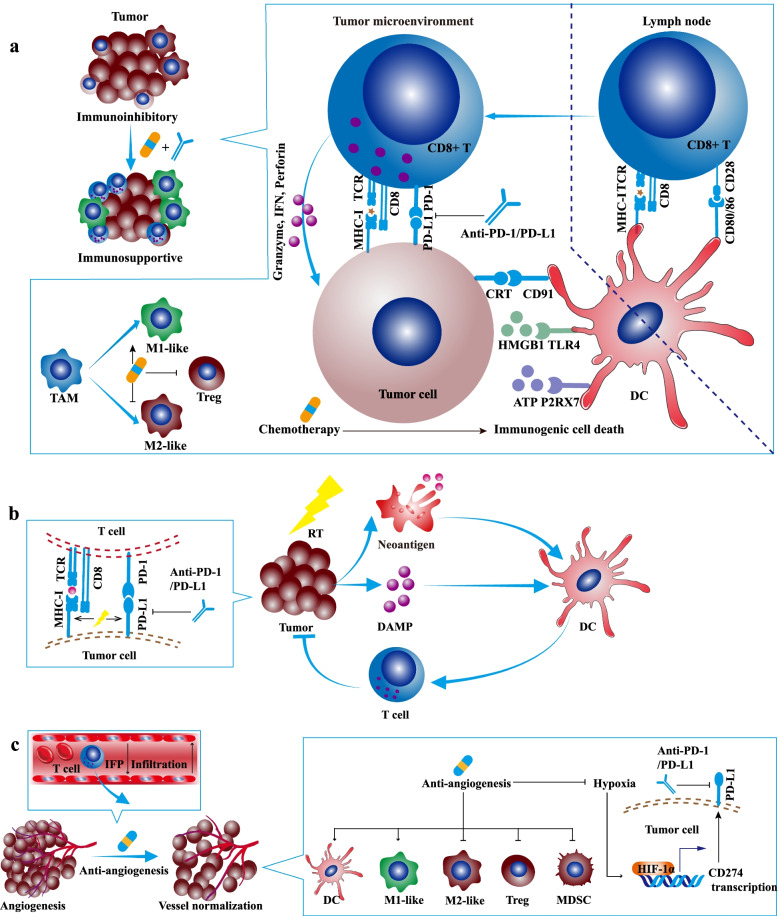
图1 PD-1/PD-L1联合化疗、放疗或血管生成抑制剂的协同抗肿瘤功效和机制
化疗主要通过阻止细胞周期、抑制DNA复制、干扰细胞代谢或抑制微管组装来延缓肿瘤生长。此外,一些细胞毒性化疗药物如蒽环类和奥沙利铂可诱导免疫原性细胞死亡并刺激抗肿瘤免疫反应(图1a)。
除了免疫原性细胞死亡外,化学疗法可以直接消除免疫抑制细胞并增强效应细胞的功能,特别是在低于最大耐受剂量的剂量下给药。例如:低剂量环磷酰胺可耗尽循环和肿瘤浸润调节性T细胞(Tregs)。除抑制细胞外,某些化学疗法如环磷酰胺、吉西他滨和长春碱以免疫原性细胞死亡方式募集和激活树突状细胞(DC)。此外,长春碱、5-氟尿嘧啶、奥沙利铂等化疗药物可直接增强DC功能,促进IL-12分泌。培美曲塞通过改善线粒体生物合成增强了肿瘤浸润淋巴细胞(TIL)的活化。
基于化疗药物的免疫调节作用,化疗可能是PD-1/PD-L1的合适搭档,以实现快速和长期的癌症控制。如今,化疗联合PD-1/PD-L1已经成为一些癌症患者的标准治疗选择,并且有数百个正在进行的临床试验探索化疗联合PD-1/PD-L1的疗效和安全性。
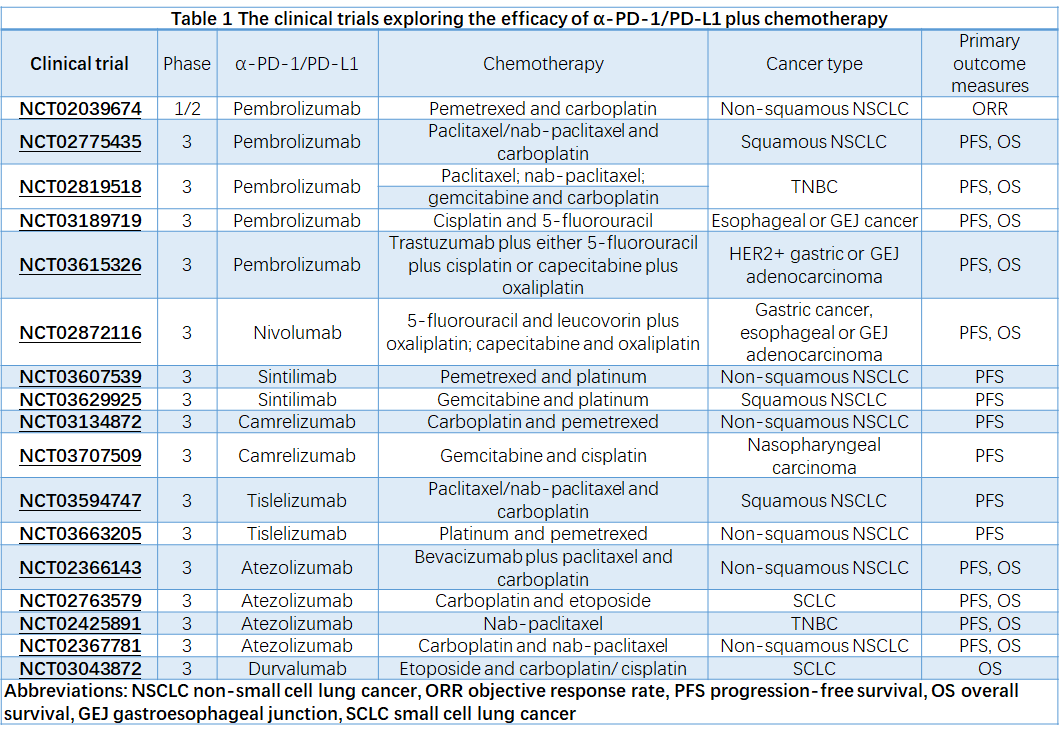
与一些化疗药物一样,放疗可以诱导免疫原性细胞死亡并增强抗肿瘤免疫反应。一方面,免疫原性细胞死亡相关的DAMP和细胞因子,尤其是IFN-I募集免疫细胞并促进DC的功能。另一方面,释放的肿瘤抗原可以被DC捕获并呈递给T细胞。因此,放射治疗不仅可以消除局部病变,还可以刺激全身抗肿瘤免疫反应。
临床前和临床研究表明,放射治疗可以以多种方式协同PD-1/PD-L1。首先,放疗促进了T细胞浸润,增加了TIL的数量,并扩大了TME中的T细胞受体(TCR)库。其次,放疗上调了肿瘤细胞上PD-L1的表达,这可以被额外的PD-1/PD-L1所利用。第三,放疗增加了肿瘤细胞上的MHC-I并减轻了对PD-1/PD-L1的耐药性(图1b)。
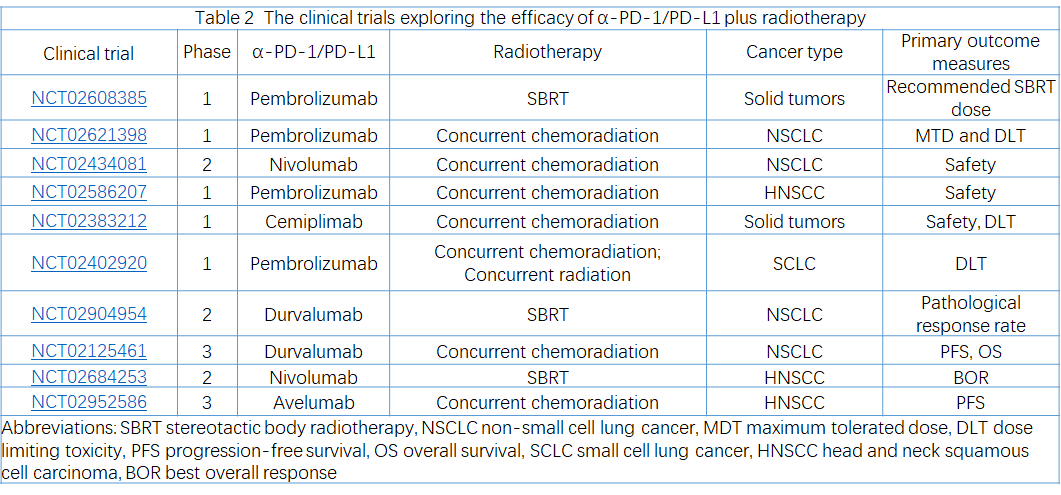
血管生成抑制剂阻断促血管生成途径,促进血管正常化,改善肿瘤灌注和氧合,恢复缺氧TME,并增强药物输送。
此外,血管生成抑制剂重塑了TME:
促进T细胞浸润和DC成熟,增强向M1样巨噬细胞的分化,降低Treg和MDSC的比例,减轻缺氧诱导的PD-L1(图1c)。
在多项临床前研究中,血管生成抑制剂增强了PD-1/PD-L1在小鼠肿瘤模型中的功效。
双免疫检查点阻断剂或共刺激分子激动剂联合PD-1/PD-L1
CTLA-4主要在活化的T细胞和Treg上表达,作为T细胞活化的负调节因子。一方面,CTLA-4可以竞争性地抑制CD28与CD80/CD86的结合,阻止T细胞活化的次级信号。另一方面,CTLA-4与CD80/CD86结合可通过SHP-2和蛋白磷酸酶2A(PP2A)抵消TCR诱导的下游信号传导并抑制PI3K-Akt通路(T细胞活化的重要信号传导)。
Ipilimumab
(由百时美施贵宝开发)是第一个获批的CTLA-4药物,最初用于晚期黑色素瘤。到目前为止,易普利姆玛的抗肿瘤活性机制仍不清楚。理论上,Ipilimumab可阻断CTLA-4与CD80/CD86的结合,消除免疫抑制信号,并促进T细胞启动。然而,多项研究已证实,Treg的抗体依赖性细胞介导的细胞毒性也大大有助于Ipilimumab的抗肿瘤活性。
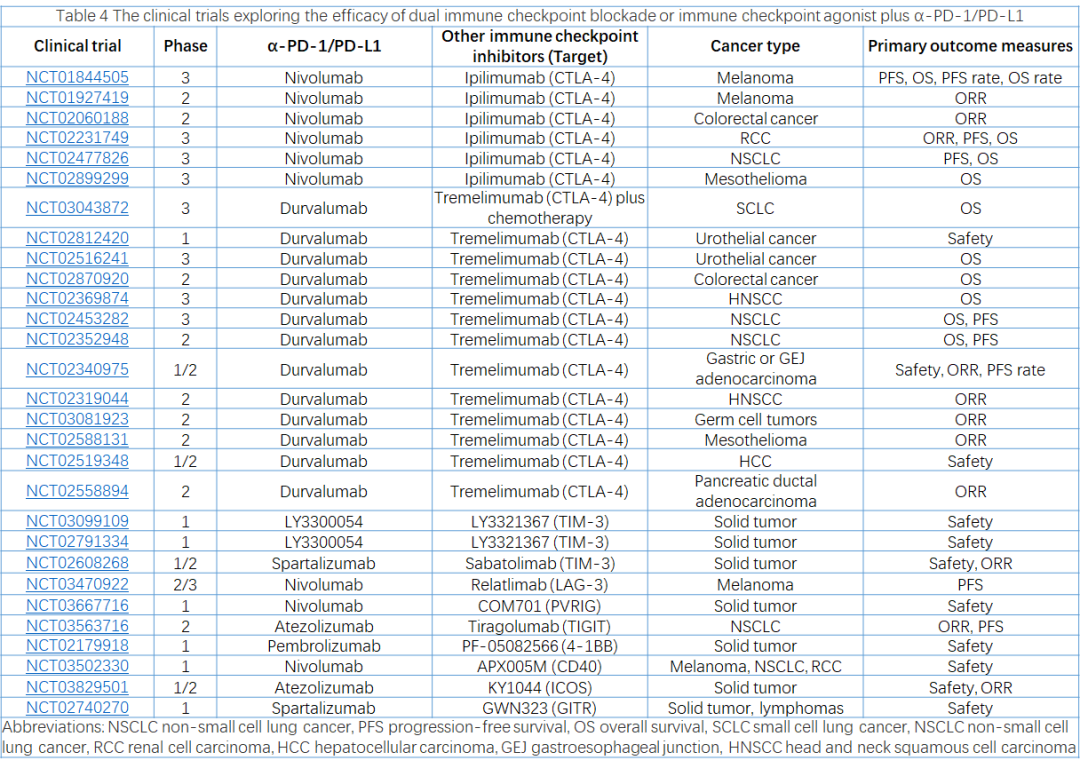
在临床上,Ipilimumab很少单独使用。相反,Ipilimumab通常与Nivolumab联合使用。FDA已批准Ipilimumab加Nivolumab用于黑色素瘤、RCC、MSI-H/dMMR结直肠癌、HCC、PD-L1阳性NSCLC和恶性胸膜间皮瘤。














