

摘
要:
目的
研究古籍记载的闹羊花不同炮制品的毒性和药效的相关性,确定“减毒
-
存效”的最佳炮制方法。
方法
采用分光测色仪、高效液相色谱电雾式检测器法(
HPLC-CAD
)、小鼠急性毒性实验、二甲苯致小鼠耳肿胀实验分别对闹羊花生品及不同炮制品的性状(颜色)、指标性成分含量、毒性、药效进行评价。
结果
相较于生品,闹羊花经炮制后饮片颜色由灰黄色变为棕褐色,指标性成分闹羊花毒素
II
、
III
、
V
含量大幅度降低,
3
种毒性成分总量的顺序为生品(
0.340%
)>清
蒸(
0.181%
)>酒蒸(
0.178%
)>醋蒸(
0.154%
)。小鼠急性毒性实验表明,闹羊花不同炮制品半数致死量(
medianlethal dose
,
LD
50
)的大小顺序为醋蒸(
3.538 g/kg
)>酒蒸(
3.467 g/kg
)>清蒸(
2.725 g/kg
)>生品(
2.172 g/kg
),表明炮制达到了“减毒”的目的。抗炎药效实验表明,闹羊花炮制前后均能抑制二甲苯致小鼠耳肿胀,抑制率大小顺序为生品高剂量组(
73.25%
)
>生品中剂量组(
58.39%
)>酒蒸高剂量组(
49.63%
)>醋蒸高剂量组(
42.48%
)>清蒸高剂量组(
40.56%
),相较于对照组均有显著性差异(
P
<
0.05
、
0.01
),达到了“存效”的目的。
结论
闹羊花的多种炮制方法均有“减毒存效”
作用,“减毒”以醋制为优,“存效”以酒制为优,为临床用药提供了依据,同时建立了毒性中药“外观性状
-
化学成分
-
毒性
-
药效”多元评价模式,为闹羊花炮制工艺、质量标准、减毒存效机制等研究奠定了理论基础。
闹羊花为杜鹃花科杜鹃属植物羊踯躅
Rhododendronmolle
(Blume)
G. Don.
的干燥花,始载于《神农本草经》,有大毒,羊食时踯躅而死,故以此为名
[1]
。其具有祛风除湿、散瘀定痛的功效,自古广泛应用于风湿痹症
[2-3]
。但与此同时其“毒性”问题也备受关注。闹羊花毒性剧烈,安全窗较窄,有效剂量接近中毒剂量,导致临床中毒事件屡有发生,极大地限制了其临床应用及深度开发。因此,在确保临床药效前提下,提出有效的减毒策略,成为目前研究的关键。
中药炮制技术可降低闹羊花毒性。闹羊花在古代多炮制入药,最早可追溯到东晋《肘后备急方》
[4]
:
“清酒二斗渍之”“苦酒渍药一宿”,《本草纲目》
[5]
也有记载“贼风走皮中淫淫痛……酒蒸为末”“酒拌蒸一炊久”。然而,现今无论是国家标准还是地方标准,均未收录闹羊花炮制品。闹羊花作为《中国药典》
2020
年版
[2]
10
种“大毒”中药材之一,是唯一一味无炮制规格的可供内服的“大毒”中药材,古代炮制方法均未得到较好的传承和发展。《中国民族药炮制经验集成》
[6]
收录了闹羊花酒蒸、炒
2
种炮制方法,并明确其炮制作用为“生品有毒,蒸、炒可降低毒性”,然而对其炮制“减毒”作用,目前尚缺乏科学依据,亦未见文献报道。
现代研究表明,闹羊花主要成分为二萜类、黄酮类、三萜类、木脂素类,其中二萜类成分为该药材特征性成分,该类成分具有强烈毒性,同时也是药效成分,具有双重生理作用,低剂量表现为抗炎、镇痛、免疫抑制、降血压等药理作用,高剂量表现为对神经系统、脏器系统、呼吸系统的毒性
[7]
。对毒性成分也是药效成分的闹羊花而言,炮制减毒技术是降低其毒性的主要目的,但不是唯一目的,在降低毒性的同时保存较高的疗效才是最终目标
[8]
。因此,本研究以古籍记载的炮制方法为依据“遵古炮制”,采用“外观性状
-
化学成分
-
毒性
-
药效”多角度评价模式,分析闹羊花炮制前后及不同炮制品的差异,以筛选最佳“减毒存效”的辅料及炮制方法,为后期闹羊花减毒存效机制、炮制工艺、质量标准等研究奠定理论依据,以期为临床提供“低毒高效”的闹羊花炮制品种,保障临床用药安全有效。
1
材料
1.1
仪器
Thermo Ultimate 3000
液相色谱仪、
CoronVeo RS
电雾式检测器(赛默飞世尔科技有限公司);
BN3000
型万分之一电子天平(上海精密科学仪器有限公司);
CP2000
型十万分子一电子天平(德国
Sartorius
公司);
HX-200k
型高速粉碎机(浙江省永康市溪岸五金药具厂);
UPTUO-I-1000TE
优普系列超纯水机(成都纯水科技有限公司);
DHG-9245A
型电热鼓风干燥箱(上海一恒科技有限公司);
SG8200HDT
型超声波清洗器(上海冠特超声仪器有限公司);
WatersC
18
色谱柱(
Sysmmetry Shield
TM
RP
18
,
250mm
×
4.6 mm
,
5 μm
);
CM-5
型分光测色仪(日本柯尼卡美能达公司);实验用鼠耳打孔器(泽雅科教有限公司)。
1.2
试药
闹羊花药材(批号
20200103
)购自湖北富饶农业药用植物繁育基地,经成都中医药大学中药资源与鉴定系严铸云教授鉴定为杜鹃花科杜鹃属植物羊踯躅
R. molle
(Blume)
G. Don.
的干燥花。甲醇(色谱纯,美国
MTEDIA
有限公司),甲醇(分析纯,成都市科龙化工试剂厂),实验用水为超纯水,醋、黄酒购自永辉超市。闹羊花毒素
III
对照品(批号
11984-201901
)、闹羊花毒素
II
对照品(批号
11983-201901
)购自中国食品药品检定研究院(质量分数≥
98%
),闹羊花毒素
V
对照品(批号
DS7190922
)购自德思特生物有限公司(质量分数≥
98%
)。
1.3
动物
SPF
级昆明种小鼠
356
只,雌雄各半,
4
~
6
周龄,体质量
18
~
22 g
,购自湖南斯莱克景达实验动物有限公司,动物许可证号
SCXK
(湘)
2019-0004
。动物饲养温度为(
20.0
±
0.5
)℃,湿度(
55
±
5
)
%
。本研究严格按照中华人民共和国科技部《动物实验管理条例》的要求进行。动物实验规程经重庆市中医院动物实验伦理委员会批准(批准号为
2019KY-GXH
)。
2
方法与结果
2.1
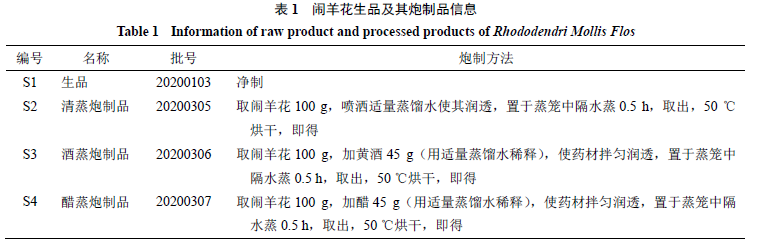
闹羊花不同炮制品的制备
根据古籍记载“遵古炮制”,具体炮制方法见表
1
。
2.2
闹羊花生品及不同炮制品颜色比较
2.2.1
肉眼观察
采用相机(佳能
Canon IXUS285HS
)对不同样品进行拍摄,见图
1
。结果可见,闹羊花生品为灰黄色,经炮制后均变为棕褐色,生品与炮制品的颜色差别较大,易区分,不同炮制品之间的颜色差异不明显。

2.2.2
颜色的测定
采用分光测色仪对闹羊花生品及其炮制品的颜色指标进行测量并记录。测量条件:光源
D
65
;标准观察角度是
10
°
;照明口径
Ф30 mm
;照明系统镜面反射。
L
*
代表明亮度,
L
*
越大,明亮度越大,反之越小;
a
*
代表红绿色度,+
a
*
为红色方向,反之为绿色方向,+
a
*
越大,则颜色越红,反之则颜色越绿;
b
*
代表黄蓝色度,+
b
*
为黄色方向,反之为蓝色方向,+
b
*
越大,则颜色越黄,反之则颜色越蓝
[6]
。
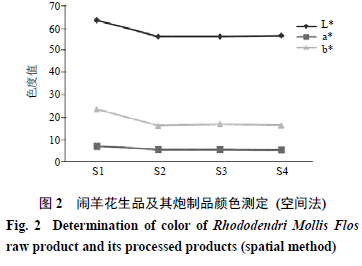
取闹羊花生品及不同炮制品,粉碎,过
2
号筛,取适量粉末放入色差仪粉末测试盒测定,见图
2
。结果表明,闹羊花炮制前后粉末的颜色存在较大差异,以
L
*
(亮度值)变化最大,其次是
b
*
(黄度值);不同炮制品(
S2
~
S4
)之间颜色无明显差异。
2.3
闹羊花毒素
II
、
III
、
V
的含量测定
2.3.1
混合对照品溶液的制备
分别精密称取闹
羊花毒素
II
、闹羊花毒素
III
、闹羊花毒素
V
对照品适量,加甲醇溶解,制成质量浓度分别为
860.09
、
670.06
、
310.03 μg/mL
的混合对照品溶液。
2.3.2
供试品溶液的制备
精密称取闹羊花药材粉末(过
4
号筛)
2.0g
,置于具塞锥形瓶中,精密加入
80%
甲醇
20 mL
,浸泡
20 min
,称定质量,超声提取
1 h
,放冷,再称定质量,用
80%
甲醇补足,过
0.22μm
微孔滤膜,取续滤液,即得。
2.3.3
色谱条件
Waters C
18
色谱柱(
250 mm
×
4.6 mm
,
5 μm
),甲醇(
A
)
-
流动相水(
B
)梯度洗脱:
0
~
10 min
,
20%
~
30% A
;
10
~
30 min
,
30%
~
40% A
;
30
~
50 min
,
40%
~
50% A
。体积流量
0.8 mL/min
;柱温
35
℃
;进样量
20 μL
;电喷雾检测器以氮气为载气,雾化温度
35
℃
,功能参数
PF
(
power function
)为
1.0
,采集频率
10 Hz
,过滤常数
3.6
。本实验条件下所测的
3
种成分与相邻色谱峰的分离度均大于
1.5
与其他组分分离完全,拖尾因子在
0.95
~
1.05
,理论塔板数大于
6000
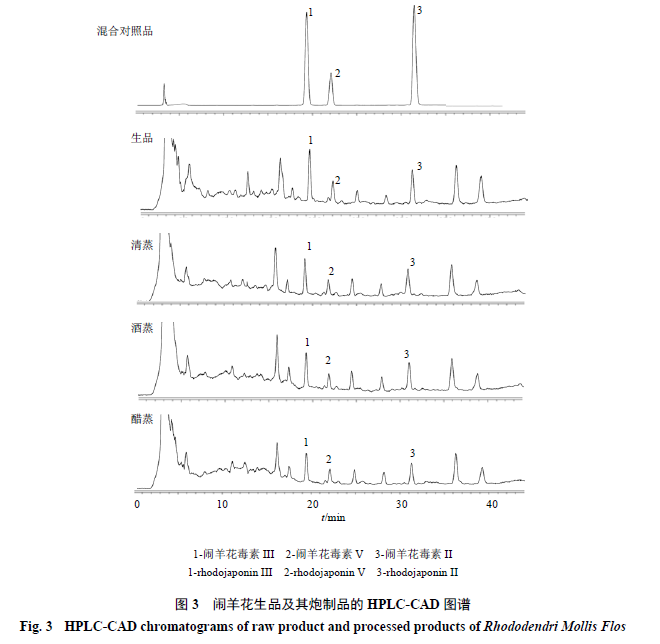
,色谱系统适用性实验符合含量测定要求。混合对照品溶液、供试品溶液(
S1
~
S4
)的色谱图见图
3
。
2.3.4
线性关系考察
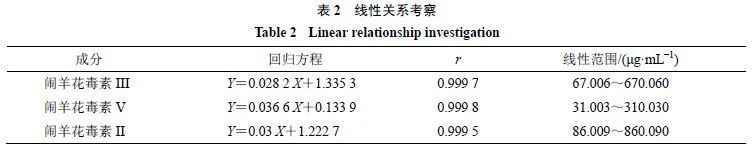
精密吸取混合对照品溶液
0.5
、
1.0
、
2.0
、
2.5
、
4.0
、
5.0mL
分别置
5 mL
量瓶中,用
80%
甲醇稀释定容至刻度,摇匀,即得;分别精密吸取上述混合对照品溶液各
20 μL
进样,测定,以进样质量浓度(
μg/mL
)为横坐标(
X
),以峰面积为纵坐标(
Y
),绘制标准曲线,结果见表
2
,
r
均大于
0.999 5
,表明
3
种被测成分在各自线性范围内呈良好线性关系。
2.3.5
方法学考察
取同一批闹羊花的供试品(
S1
),制备供试品溶液,进样测定,分别进行精密度试验、重复性试验、稳定性试验,计算各色谱峰
的相对峰面积与相对保留时间。结果显示各共有峰的相对保留时间和相对峰面积的
RSD
均小于
3%
,表明方法精密度及重复性良好,且供试品溶液在
24
h
内稳定,符合含量测定要求。
2.3.6
样品测定
精密称取闹羊花生品(
S1
)及不同炮制品(
S2
~
S4
),按“
2.3.2
”项下方法制备供试品溶液,分别精密吸取
20 μL
,按“
2.3.3
”项下色谱条件测定,计算样品含量,见表
3
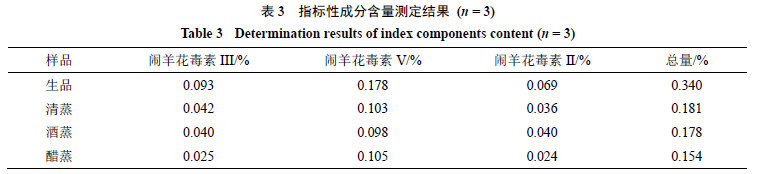
。结果表明,经炮制后
3
种成分的含量均有所降低,总量顺序为生品(
0.340%
)>清蒸(
0.181%
)>酒蒸(
0.178%
)>
醋
蒸(
0.154%
),其中醋蒸品降低了约
50%
。闹羊花
毒素
III
以醋蒸品降低最多,闹羊花毒素
V
以酒蒸品降低最多,闹羊花毒素
II
以醋蒸品降低最多。
2.4
闹羊花生品及其不同炮制品的急性毒性评价
2.4.1
供试药的制备
分别取闹羊花生品(
S1
)及不同炮制品(
S2
~
S4
)各
20 g
,加
25
倍量的
60%
乙醇,加热回流提取
2
次,每次
1 h
,滤过,合并滤液,
50
℃
减压浓缩至
50mL
,冷藏备用。上述各样品临用前用
CMC-Na
溶液稀释成所需浓度。
2.4.2
急性毒性预试验
参照《中药、天然药物急性毒性研究技术指导原则》
[7]
进行急性毒性实验,观察各组药物的毒性反应,测定致死剂量。采用少量动物探索剂量范围,取小鼠
16
只,体质量
23
~
27 g
,雌雄各半,随机分成闹羊花生品组、清蒸组、酒蒸组、醋蒸组
4
组,相邻组间剂量比为
0.5
,
ig
给药,每次给药容量为
0.02 mL/g
,得出各炮制品的
0
~
100%
致死量(
D
n
~
D
m
)。
2.4.3
急性毒性正式实验
根据
D
m
(生品为
4.0 g/kg
,炮制品均为
6.0 g/kg
)和
D
n
(生品为
1.3 g/kg
,炮制品均为
1.8 g/kg
)
,每个药物设置
5
个剂量,相邻组间剂量比为
0.75
。取
200
只小鼠,雌雄各半,随机分为闹羊花生品组、清蒸组、酒蒸组、醋蒸组,各组再分为
5
个不同剂量组,每组
10
只。给药前小鼠禁食不禁水,次日各组小鼠分别
ig
相应剂量药物,给药体积为
20 μL/g
。给药后观察每组小鼠的中毒症状、生存状态,连续观察
14 d
,记录各组小鼠的毒性反应出现时间、死亡时间、死亡数量。
2.4.4
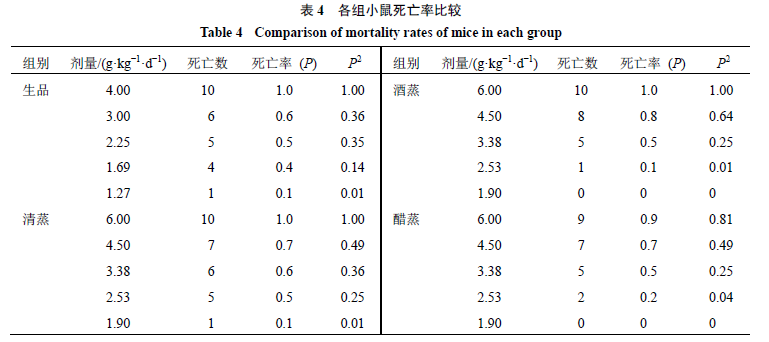
急性毒性结果
从
ig
后
5 min
,各组小鼠均出现不同程度的中毒症状,表现为出汗、腹泻、口吐白沫、运动不协调、呼吸急促、痉挛、僵直、大小便失禁等,抽搐,直至死亡,死亡时间集中在给药后
2 h
内。解剖死亡小鼠可见肺部有不同程度水肿,胃胀、部分肠管充盈,心肌肥大,肝脏发黑。根据各组小鼠死亡数计算出死亡率,见表
4
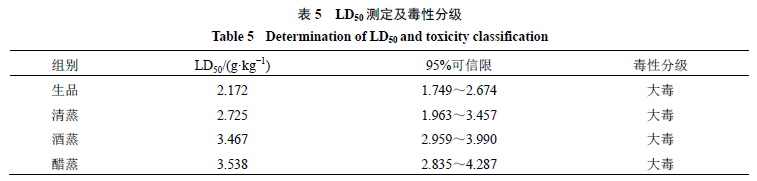
。半数致死量(
median lethal dose
,
LD
50
)是判断中药有无毒性及毒性大小的依据,毒性与
LD
50
呈负相关,一般认为大毒中药
LD
50
<
5 g/kg
,有毒中药
LD
50
介于
5
~
15g/kg
,采用
Bliss
法计算
LD
50
及
LD
50
的
95%
可信限,见表
5
。急性毒性结果表明,闹羊花经炮制后急性毒性均有所降低,尤以醋蒸品毒性最低,
LD
50
的大小顺序为醋蒸>酒蒸>清蒸>生品。
2.5
闹羊花生品及其不同炮制品的抗炎作用评价
2.5.1
分组及给药
取
140

















