
2022年9月22日
,上海交通大学医学院/上海市免疫学研究所
李华兵
研究员团队、北京大学生命科学学院
伊成器
教授、
吴玉章
团队和
Richard
等合作在
Nature Immunology
上发表了题为
tRNA-m
1
A modification promotes T cell expansion via efficient MYC protein synthesis
的研究论文,该研究揭示了m
1
A修饰催化酶tRNA methyltransferase 61A
(
TRMT61A
)
通过催化新合成tRNA第58位腺嘌呤的甲基化
(m
1
A)
,加速CD4
+
T细胞激活后多种关键蛋白的翻译,保证CD4
+
T细胞的迅速免疫应答。
该研究首次详细地阐明了CD4
+
T细胞功能改变过程中tRNA化学修饰控制细胞内翻译的分子机制。
CD4
+
T细胞作为机体适应性免疫系统的重要组成部分,其在接受抗原刺激时,会快速激活以脱离静息状态,随后进入大量克隆扩增和分化阶段,以满足机体免疫防御的需求。为了实现迅速且充分的免疫应答效应,T细胞通常会通过提高转录水平以合成更多mRNA来实现对关键功能蛋白“质”和“量”的调控。然而,短时间内转录水平增加介导的蛋白合成能力远远满足不了CD4
+
T细胞激活早期对大量蛋白质合成的实际需求,因此,李华兵研究员及合作团队推测CD4
+
T细胞可能会采取通过提高现有mRNA池的翻译效率这一策略以快速应对T细胞早期功能的改变。
为了明确CD4
+
T细胞激活早期细胞内各种基因调控进程的活跃度,研究人员首先对初始 CD4
+
T细胞进行不同时间点的TCR激活处理,并进行转录组学分析,结果发现CD4
+
T细胞激活后的18小时内,蛋白质翻译通路是上调最活跃的遗传信息处理进程,其中参与tRNA加工和化学修饰的转录本上调最为显著。为了进一步确定这一现象,课题组又进行了tRNA测序,并发现在CD4
+
T细胞激活早期确实大部分tRNA表达显著增加,因此证明了CD4
+
T细胞激活早期的重要任务
:通过提高tRNA的含量以实现翻译效率的大幅提升
。
机体细胞除了采用改变tRNA表达量来调控翻译外,也会通过影响tRNA上的多种化学修饰来改变翻译进程。大量研究表明,tRNA上的化学修饰是维持tRNA结构稳定和高效解码效率的重要因素,其中,位于第58位腺嘌呤上的甲基化修饰
(tRNA-m
1
A58)
在多种生物中保守存在,并且该修饰对维持tRNA的解码效率至关重要。课题组通过转录组学、实时定量PCR以及免疫印记实验证明tRNA-m
1
A58催化酶TRMT6/61A在CD4
+
T细胞激活后迅速增加以保证新合成tRNA中m
1
A58的添加,从而保证tRNA的高效翻译能力。
为了探究tRNA-m
1
A58在CD4
+
T细胞激活过程中调控翻译效率的重要性,研究团队首先构建了在T细胞中特异性敲除
Trmt61a
的基因缺陷小鼠,并发现
Trmt61a
条件性敲除小鼠随着年龄的增加表现出自发肠炎表型,伴随着肠系膜淋巴结肿大。通过分析小鼠免疫细胞组成,发现外周免疫器官中CD4
+
T和CD8
+
T细胞的比例和数量也发生改变,其中脾脏T细胞数量减少,淋巴结中T 细胞数量增加,但效应记忆性CD4
+
T细胞组成比例均降低,表明TRMT61A缺失导致外周T细胞稳态被扰乱,但T细胞在胸腺中的发育仍然正常。随后利用体外原代T细胞培养技术,研究人员进一步明确TRMT61A缺失会导致CD4
+
T细胞激活后无法顺利地从G0/G1期进入S期,引起增殖能力显著降低。同时,通过一系列体内、体外实验发现
Trmt61a
缺失导致CD4
+
T细胞中大部分tRNA的m
1
A58修饰显著减少,在翻译延伸中的解码能力显著下降,最终导致CD4
+
T细胞激活后多种关键蛋白的翻译受阻,特别是CD4
+
T细胞激活早期需要快速增加表达的转录因子MYC。
MYC蛋白的降低导致CD4
+
T细胞激活后代谢重编程和细胞周期发生紊乱,最终使CD4
+
T细胞激活后的快速克隆扩增受阻。
接下来,研究团队通过翻译组学
(RiboTag-seq)
分析发现,
Trmt61a
缺失确实导致CD4
+
T细胞中一部分基因
(包括
Myc
)
的翻译效率显著降低,但大部分基因的翻译效率并未改变,有些基因的翻译效率反而升高。随之而来一个问题:tRNA-m
1
A58修饰减少为什么仅降低部分基因的翻译效率?为了解决这一困惑,研究人员首先利用tRNA甲基化测序技术检测了
Trmt61a
缺失的CD4
+
T细胞中tRNA-m
1
A58修饰的变化情况,结果发现大部分tRNA上的m
1
A58修饰丰度都显著减少,但不同tRNA减少幅度不同,提示不同tRNA对
Trmt61a
缺失的敏感性不同。随后团队成员利用多组学联合分析发现,对
Trmt61a
缺失高度敏感的tRNA正是CD4
+
T细胞激活早期需要快速增加的tRNA,而这些tRNA又是翻译效率下调基因偏好优先使用的一群tRNA,因此当
Trmt61a
缺失后,首当其冲受到影响的便是这些快速增加的tRNA以及偏好使用这些tRNA的重要功能基因的表达。
最后,课题组对
Myc
mRNA进行了密码子转换实验,将其中对
Trmt61a
缺失高敏感的tRNA解码的密码子同义替换为低敏感tRNA解码的密码子。替换密码子后,
Myc
mRNA在
Trmt61a
缺失的CD4
+
T细胞中翻译效率得以恢复。更重要的是,当把密码子替换后的
Myc
mRNA转入到
Trmt61a
缺失的CD4
+
T细胞中,CD4
+
T细胞的增殖能力也得到恢复。
tRNA的作用、tRNA的修饰和密码子使用的选择性等相关研究在T细胞领域极少涉及,
该研究第一次将tRNA修饰与T细胞的功能变化连接起来,并系统性地探究了原代CD4
+
T细胞扩增过程中控制翻译的具体机制,表明tRNA的使用及其修饰可以对蛋白表达和细胞功能带来显著改变
。区别于李华兵研究员团队以往发现的METTL3介导的m
6
A修饰是CD4
+
T细胞激活的“转录检查点”功能
(
Nature
2017)
,这项研究表明TRMT61A介导的tRNA-m
1
A58修饰作为CD4
+
T细胞增殖调控的新型“翻译检查点”
(下图)
,将为改善CD4
+
T细胞介导的炎症应答及增强肿瘤免疫治疗效果提供新的RNA表观遗传策略。
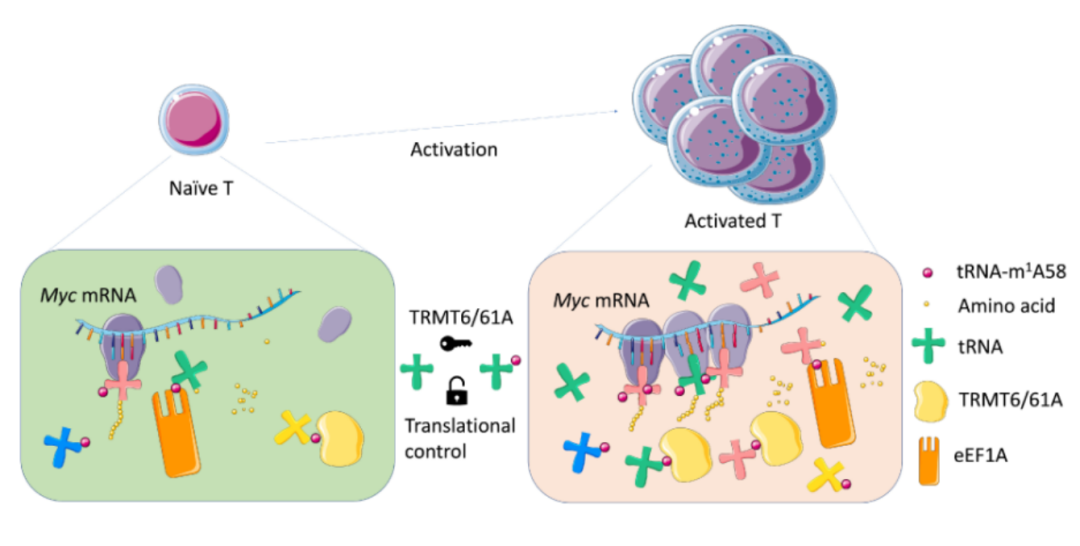
TRMT61A介导的tRNA-m
1
A58修饰是CD4
+
T细胞激活增殖调控的“翻译检查点”
据悉,上海交通大学医学院刘永波、周静副研究员和硕士研究生施金彤,浙江大学医学院李笑雨研究员,北京大学生命科学学院博士研究生张晓婷为本论文的共同第一作者,上海交通大学医学院李华兵研究员、北京大学生命科学学院伊成器教授、陆军军医大学吴玉章教授及耶鲁大学医学院Richard A.Flavell教授为该文的共同通讯作者。
https://www.nature.com/articles/s41590-022-01301-3
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。






