根据咸达数据,近一周(2023.4.24-2023.5.3)8个新药申报上市已获CDE承办;39个新药申报临床已获CDE承办;19个品种提交一致性评价申请。
|
申报上市
近一周CDE承办的申报上市新药,共计8个,其中2个为化药,5个为治疗用生物制品,1个为中药,详情如下:
化药

普卢格列汀片
本品
是一种新型口服二肽基肽酶-IV(DPP-4)抑制剂,对DPP-4具有高选择性和强抑制性。通过抑制DPP-4,使内源性活性胰高血糖素样肽-1(GLP-1)水平升高从而增强β细胞和α细胞对葡萄糖的敏感性,增加葡萄糖刺激的胰岛素分泌并增强葡萄糖对胰高血糖素分泌的抑制作用,进而降低血糖水平且不诱发低血糖和增加体重。临床研究显示该产品具有持久的降糖作用且不良反应发生率较低,将为2型糖尿病患者的治疗提供更多选择。
2022年,石药集团曾公布普卢格列汀片两项III期临床试验结果,用于支持上市申报。其中,普卢格列汀单药临床研究表现了优于对照组,同时非劣于阳性药物磷酸西格列汀片。另一项联合二甲双胍的临床研究也显示,相对于安慰剂联合二甲双胍,普卢格列汀联合二甲双胍显示了治疗优势。
硫酸阿托品滴眼液
本品
以硫酸阿托品为活性成分的眼用制剂(SQ-729),此次申报适应症为:用于延缓儿童近视进展。
治疗用生物制品
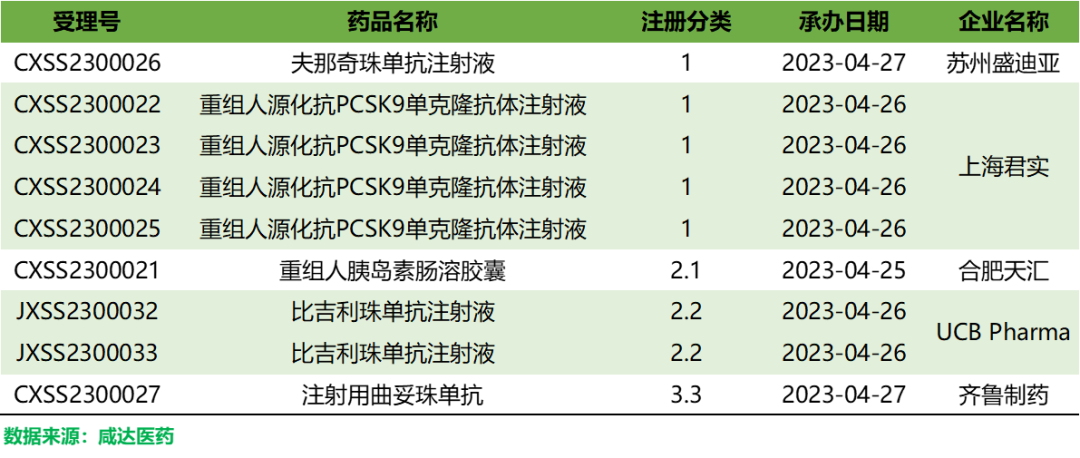
夫那奇珠单抗注射液
本品是恒瑞
自主研发的一种靶向人IL-17A的重组人源化单克隆抗体,
此次申报上市,是基于一项多中心、随机、双盲、平行、安慰剂对照的Ⅲ期临床试验(SHR-1314-301)。研究表明,与安慰剂相比,夫那奇珠单抗注射液对中重度斑块状银屑病具有统计学显著性和临床意义的改善。同时,SHR-1314注射液在中重度慢性斑块状银屑病患者中长期治疗的安全性、耐受性良好。
重组人源化抗PCSK9单克隆抗体注射液
本品是
君实生物自主研发的注射用重组人源化抗PCSK9单克隆抗体,本次上市申请主要基于三项注册临床试验(JS002-003、JS002-004、JS002-006)。其中,JS002-003和JS002-006是在原发性高胆固醇血症(包括杂合子型家族性和非家族性)和混合型高脂血症患者中完成的两项随机、双盲、安慰剂对照的III期临床研究,JS002-004是在HoFH患者中完成的一项单臂、开放标签的II期临床研究。
目前,在国内信达生物已于2022年6月向CDE递交了PCSK9抗体托莱西单抗的上市申请,成为首款申报上市的国产PCSK9 单抗。此外,康方生物的伊努西单抗三期临床已经达到主要终点,恒瑞医药的recaticimab也处在三期临床阶段,信立泰、和铂医药、前沿生物、天士力、甘宝利等的PCSK9项目也正处于研究中。此外,诺华的PCSK9 siRNA于去年11月在国内递交上市申请。
重组人胰岛素肠溶胶囊
本品
以2.1类改良新药
申报上市,这是全球首款申报上市的口服胰岛素制剂,将用于治疗口服降糖药疗效不佳的2型糖尿病患者。
本品由以色列生物技术公司Oramed制药研发,利用其自主研发的口服递送技术平台PODTM,通过将胰岛素、吸收促进剂、蛋白酶抑制剂和肠溶包衣4部分组合,可有效抑制小肠蛋白质的水解作用以及改善多肽通过肠道上皮内壁的能力,使得胰岛素进入体循环。2015年,天麦生物以5000万美元的总交易额获得本品的在大中华地区的商业化权益。
比吉利珠单抗注射液
本品
是一种人源化单克隆IgG1抗体,旨在同时抑制白细胞介素 17A(IL-17A)和白细胞介素17F(IL-17F)这两种驱动炎症过程的关键细胞因子。这种独特的作用机制相比于其他IL-17A类药物可能有更好的疗效。
bimekizumab于2021年8月在欧盟和英国获批用于适合系统治疗的成人中重度斑块状银屑病,2022年1月在日本获批,用于治疗对现有疗法响应不足的成人斑块状银屑病、泛发性脓疱型银屑病、红皮病型银屑病患者。
bimekizumab在FDA申报治疗中重度斑块状银屑病,预计将于今年年中获FDA批准上市。
注射用曲妥珠单抗
本品
是潜在的赫赛汀生物类似药,适用于人表皮生长因子受体-2(HER2)阳性的转移性乳腺癌治疗。
中药

|
申报临床
近一周CDE承办的首次申报临床新药,共计39个,其中化药24个,治疗用生物制品12个,预防
用生物制品1
个,
中药2
个,
详情如下:
化药
















